题目内容
(2012?佛山)今年1月,广西柳州龙江河发生镉污染.但镉是人类的朋友,如制造“镍-镉”充电电池.镉(Cd)的原子序数为48,相对原子质量是112.下列有关说法正确的是( )
分析:A.从元素种类的造字上分析元素的种类;
B.从原子的相对原子质量和真实质量上分析;
CD.从原子中有关微粒的数量计算方法上分析微粒的数量
B.从原子的相对原子质量和真实质量上分析;
CD.从原子中有关微粒的数量计算方法上分析微粒的数量
解答:解:A.镉字的偏旁是金字旁,故镉是金属元素.故A说法错误.
B.原子的实际质量不等于原子的相对原子质量,从题目看不能得出镉原子的实际质量,只能得出镉原子的相对原子质量是112.故B的说法错误.
C.在原子中核外电子数等于原子序数,镉(Cd)的原子序数为48,镉原子核外电子数也应为48.故C的说法正确.
D.在原子中,中子数等于相对原子质量减去质子数,而质子数又等于原子序数,因此镉原子的中子数为112-48=64.故D的说法错误
故选C.
B.原子的实际质量不等于原子的相对原子质量,从题目看不能得出镉原子的实际质量,只能得出镉原子的相对原子质量是112.故B的说法错误.
C.在原子中核外电子数等于原子序数,镉(Cd)的原子序数为48,镉原子核外电子数也应为48.故C的说法正确.
D.在原子中,中子数等于相对原子质量减去质子数,而质子数又等于原子序数,因此镉原子的中子数为112-48=64.故D的说法错误
故选C.
点评:本题考查了原子质量的有关知识和原子中微粒数量间的关系的知识,注意在原子中“质子数=核外电子数=原子序数”和“中子数=相对原子质量-质子数”数量关系.

练习册系列答案
相关题目
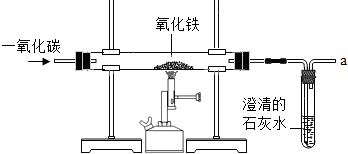 (2012?佛山)炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见图:
(2012?佛山)炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见图: (2012?佛山)氯化钠是一种重要的盐,也是人生理活动必须的物质,根据所学知识回答:
(2012?佛山)氯化钠是一种重要的盐,也是人生理活动必须的物质,根据所学知识回答: