题目内容
11.用过氧化氢和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,据此填表.| 项目 | 反应物 | 生成物 | |
| H2O2 | H2O | O2 | |
| 质量比 | 68 | 36 | 32 |
| A | 34g | 18g | 16g |
| B | 17g | 9g | 8g |
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
利用各物质之间的质量比等于相对分子质量和的比,进行分析解答即可.
解答 解:过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 36 32
34g 18g x
y 9g 8g
利用质量守恒定律,x=34g-18g=16g;y=9g+8g=17g.
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
| 项目 | 反应物 | 生成物 | |
| H2O2 | H2O | O2 | |
| 质量比 | 68 | 36 | 32 |
| A | 34g | 18g | 16g |
| B | 17g | 9g | 8g |
点评 本题难度不大,掌握化学方程式的书写方法、化学反应中各物质之间的质量比等于相对分子质量和的比是正确解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2. 众所周知,酚酞溶液遇NaOH溶液变红,但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.
众所周知,酚酞溶液遇NaOH溶液变红,但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成.
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关.
【进行实验】
【解释与结论】
(1)NaOH与CO2反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
(2)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与NaOH浓度有关,浓度过高会使酚酞褪色.
(4)实验3的操作步骤:取3支试管,分别加入2mL水,分别向三支试管中滴加5滴5%,2%,0.5%的酚酞溶液.
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%,建议选用NaOH溶液的浓度为0.5%.
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是未排除酒精对酚酞溶解的影响.
 众所周知,酚酞溶液遇NaOH溶液变红,但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.
众所周知,酚酞溶液遇NaOH溶液变红,但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物.【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成.
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关.
【进行实验】
| 实验 | 实验操作 | 实验现象 | |
| 1 | 向盛有2mL Na2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 | |
| 2 | 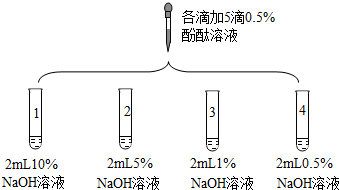 | 1号试管0.1min红色褪去 2号试管5min红色褪去 3号试管30min红色明显变浅 4号试管120min红色无明显变化 | |
| 3 | 取3支试管,分别加入2mL水,… | 酚酞溶液浓度/% | 浑浊程度 |
| 5 | 大量浑浊物 | ||
| 2 | 少量浑浊物 | ||
| 0.5 | 无浑浊物 | ||
(1)NaOH与CO2反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
(2)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与NaOH浓度有关,浓度过高会使酚酞褪色.
(4)实验3的操作步骤:取3支试管,分别加入2mL水,分别向三支试管中滴加5滴5%,2%,0.5%的酚酞溶液.
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%,建议选用NaOH溶液的浓度为0.5%.
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是未排除酒精对酚酞溶解的影响.
6.某兴趣小组为测定变质的NaOH样品溶液中Na2CO3的质量分数,分别取40g该溶液,向其中加入一定量的7.3%的HCl溶液,充分反应后.所得气体质量与所加HCl溶液质量关系如表:
(1)如表中m的值为0;
(2)请列式计算原混合溶液中Na2CO3的质量分数;
(3)第⑥次实验充分反应后所得溶液中氯元素的质量为4.26g.
| 实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| HCl溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 |
| 气体质量/g | m | 0 | 0.44 | 0.88 | 1.32 | 1.32 |
(2)请列式计算原混合溶液中Na2CO3的质量分数;
(3)第⑥次实验充分反应后所得溶液中氯元素的质量为4.26g.
16.下列对分子、原子、离子的描述,其中错误的是( )
| A. | 原子可以构成分子,原子也可以形成离子 | |
| B. | 分子之间有间隔,原子和离子之间没有间隔 | |
| C. | 分子和原子时电中性的,离子是带电的粒子 | |
| D. | 分子、原子、离子都是构成物质的基本粒子 |
1.为保证实验安全,取得预期实验效果,养成良好的实验习惯.我们应掌握正确的实验操作并遵循化学实验的安全规则,下列做法正确的是 ( )
| A. | 洗净后的试管,放置晾干的正确方法是:管口向下,倒扣在试管架上 | |
| B. | 浓硫酸沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液 | |
| C. | 滴瓶上的滴管用过后,先用水洗净再放回原瓶 | |
| D. | 在托盘天平的两盘上各放一张质量相等的白纸,将氢氧化钠固体放在左盘中纸上称量 | |
| E. | 组装气体制备装置时,遵循自下而上,先左后右的原则 | |
| F. | 用pH试纸测定溶液的酸碱度时,先将一小片pH试纸放在表面皿上,再将待测液滴到pH试纸上,观察颜色变化与标准比色卡对比,记录pH值 | |
| G. | 蒸发结束后用手将蒸发皿从铁圈上拿下来 |
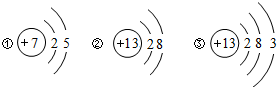 在宏观、微观和符号之间建立联系是化学学科的特点.
在宏观、微观和符号之间建立联系是化学学科的特点.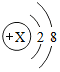 ,若该粒子带有1个单位负电荷,则X=9.
,若该粒子带有1个单位负电荷,则X=9.
