题目内容
17.化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属.流程如下:(未作特别说明的“固体”,可能为纯净物或化合物)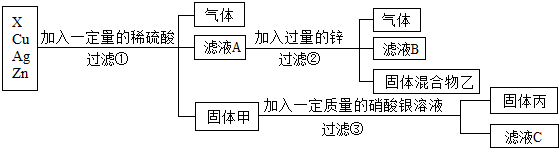
(1)四种金属的活动性有强到弱的顺序是Zn>x>Cu>Ag;
(2)过滤操作中用到的玻璃仪器有烧杯、漏斗和玻璃棒;
(3)滤液A中共含有3种溶质;
(4)为了检验滤液C中的溶质成分:向其中加入稀盐酸,有白色沉淀产生,则滤液C中一定含有的阳离子Ag+、Cu2+(填离子符号).
分析 根据金属能与酸反应的排在氢前面,不能与酸反应的排在氢的后面,活泼的金属能把不活泼的金属从盐溶液中置换出来分析金属活动性的顺序及反应过程中发生的反应并分析溶液中的成分.
解答 解:根据金属的活泼性顺序:锌>氢>铜>银,故向锌、X、铜、银的金属混合物中加入稀硫酸,锌一定参加反应产生气泡,而铜和银一定没反应,得到的滤液A再加入过量的锌得到混合物乙和滤液B,说明锌除了和过量的硫酸反应产生气体外,还和盐溶液发生了置换反应,因此说明锌的活动性比X强,且X位于氢前;由于硫酸过量,固体甲含有铜和银,铜和硝酸银反应产生硝酸铜和银.因此:
(1)四种金属的活动性顺序由强到弱的是:Zn>X>Cu>Ag;
(2)过滤操作中用到的玻璃仪器有烧杯、漏斗和玻璃棒,其玻璃棒的作用是引流;
(3)由上述分析可知,滤液A一定有硫酸锌、剩余的硫酸和x的硫酸盐三种溶质;
(4)由向其中加入稀盐酸,有白色沉淀产生,说明有硝酸银剩余,故滤液C中一定含有的阳离子是铜和硝酸银反应生成的铜离子和剩余的硝酸银中的银离子,符号为:Ag+、Cu2+.
故答为:(1)Zn>x>Cu>Ag;(2)玻璃棒; (3)3;(4)Ag+,Cu2+.
点评 此题以实验设计流程的形式让学生去利用金属活动性顺序表解决有关金属化学性质的问题,有一定的难度,解题的关键是熟练运用金属活动性的顺序意义.

练习册系列答案
相关题目
7.碘(I2)可用于测定Ve药物中的维生素C(C8H6O6)含量.下列说法不正确的是( )
| A. | I2中碘元素的化合价为0 | B. | 加碘食盐中含有的就是I2 | ||
| C. | C6H8O6的相对分子质量为176 | D. | C6H8O6属于有机物 |
2.下列对有关实验现象的描述正确的是( )
| A. | 碳在氧气中燃烧放出白烟 | |
| B. | 镁条在空气中燃烧发出耀眼的白光 | |
| C. | 铁丝在氧气中燃烧生成四氧化三铁 | |
| D. | 在滴有石蕊的盐酸中逐滴加入氢氧化钠溶液,溶液颜色由蓝色逐浙变成红色 |
9.类推是学习中常用的思维方法,现有以下类推结果,其中错误的是( )
①碱的水溶液通常呈碱性,所以碱性溶液一定是碱的溶液②氧化物都含有氧元素,所以含氧元素的化合物一定是氧化物③碱中一定含有金属离子.酸碱发生中和反应生成盐和水,所以生成水的反应一定是中和反应.
①碱的水溶液通常呈碱性,所以碱性溶液一定是碱的溶液②氧化物都含有氧元素,所以含氧元素的化合物一定是氧化物③碱中一定含有金属离子.酸碱发生中和反应生成盐和水,所以生成水的反应一定是中和反应.
| A. | 只有① | B. | ①② | C. | ①③ | D. | ①②③ |
6.工业废水任意排放会对环境造成很大污染,解决该问题已迫在眉睫.已知甲、乙两工厂,它们排放的工业废水含有CuSO4、KOH、Ba(NO3)2、NaCl、Mg(NO3)2五种物质,且甲、乙两厂排放的废水中所含的物质至少有两种不相同.
(1)经观察发现甲厂排放的废水为蓝色澄清溶液,乙厂排放的废水为无色澄清溶液,则甲厂排放的废水中一定含有CuSO4、Mg(NO3)2物质,则乙厂排放的废水中一定含有KOH、Ba(NO3)2物质
(2)小组成为继续研究氯化钠的来源(每步操作只加一种试剂),请完成实验方案
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些有害离子转化为沉淀,经过滤后的废水中含有能作肥料的物质是KNO3,可用来浇灌农田.
(1)经观察发现甲厂排放的废水为蓝色澄清溶液,乙厂排放的废水为无色澄清溶液,则甲厂排放的废水中一定含有CuSO4、Mg(NO3)2物质,则乙厂排放的废水中一定含有KOH、Ba(NO3)2物质
(2)小组成为继续研究氯化钠的来源(每步操作只加一种试剂),请完成实验方案
| 实验操作 | 实验现象 | 实验结论 |
| 取少量甲厂的废水与试管中 1.先向其中滴加适量的氢氧化钠溶液 2.再向其中滴加硝酸银溶液 | 1.产生沉淀 2.产生白色沉淀 | 氯化钠来自甲厂 |
 如图所示是医院常用的药瓶和注射器,请你据图回答:
如图所示是医院常用的药瓶和注射器,请你据图回答: 如图所示的是物质A~F相互间的关系(“→”表示物质间存在的转化关系,“-”表示两端的物质能发生化学反应).通常情况下A是能参与绿色植物光合作用的气体;B是工业上广泛用于玻璃、造纸、纺织和洗涤剂生产等领域;D的溶液呈蓝色;E搜地壳中含量最多的金属元素的单质.请回答下列问题.
如图所示的是物质A~F相互间的关系(“→”表示物质间存在的转化关系,“-”表示两端的物质能发生化学反应).通常情况下A是能参与绿色植物光合作用的气体;B是工业上广泛用于玻璃、造纸、纺织和洗涤剂生产等领域;D的溶液呈蓝色;E搜地壳中含量最多的金属元素的单质.请回答下列问题.