题目内容
10.如图是元素周期表1-3周期的原子结构简图和37号元素伽(元素符号为Rb)的原子结构简图: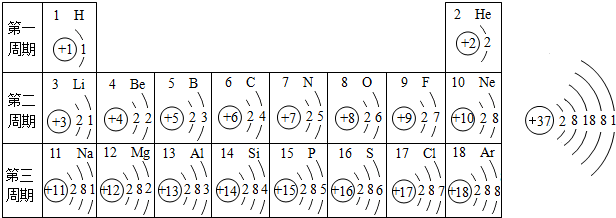
(1)在第二周期中,各元素原子结构的共同点是电子层数都是2.
(2)第二、三周期中,各元素原子最外层电子数的变化规律是逐渐递增(或从1到8逐渐递增).
(3)第三周期元素中,核外电子排布与Ar相同的离子符号Cl-(写一个).
(4)写出伽的氧化物的化学式Rb2O.
分析 (1)依据同周期元素的原子结构的共同点分析解决;
(2)根据在元素周期表中,随原子序数的递增,原子结构中电子层数、最外层电子数发生规律性的变化解答本题;
(3)氩原子核外有18个电子,据此进行分析解答.
(4)根据电子层数等于周期数解答,由化合价书写化学式.
解答 解:(1)同一周期的元素其电子层数一定相同,第二周期元素电子层数都是2层;
(2)在元素周期表中,随原子序数的递增,同一周期元素最外层电子数逐渐增多的规律.
(3)氩原子核外有18电子,氯原子得1个电子形成氯离子,氯离子核外有18个电子,其离子符号为:Cl-.
(4)根据电子层数等于周期数,铷的核外有5个电子层故在元素周期表中位于第5周期;铷的最外层电子数是1,故化合价为+1价,氧的化合价为-2价,故铷的氧化物的化学式Rb2O;
答案:(1)电子层数都是2;(2)逐渐递增(或从1到8逐渐递增);(3)Cl-(4)Rb2O
点评 本题考查学生熟练掌握应用元素周期表所提供的信息进行分析解题的能力,属基础性知识考查题.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
18.我国研制的用于航天飞机的固体推进剂是铝粉与高氯酸铵的混合物,点火时发生如下反应:2NH4ClO4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+4X+Cl2↑+2O2↑,则X的化学式为( )
| A. | NH3 | B. | H2O | C. | ClO2 | D. | HCl |
5.河南省已于2015年5月1日起强制实施胡辣汤、花生糕制品、水磨白糯米粉等7种食品的地方标准.下列不是富含蛋白质的食品的是( )
| A. | 糯米饭 | B. | 豆腐脑 | C. | 花生糕 | D. | 鸡蛋糕 |
2.下列有关钢铁的叙述不正确的是( )
| A. | 生铁和钢都属于铁合金 | |
| B. | 钢的硬度大于纯铁的硬度 | |
| C. | 铁丝在氧气中剧烈燃烧,火焰明亮,生成黑色固体 | |
| D. | 炼铁的主要原料有铁矿石、焦炭、石灰石 |
19.2015年5月23日中国医学科学院药物研究所研究人员发现了一种新物质,并向中国专利技术局申请了专利,该物质被CAS登记为第6000万种已知结构的新物质M(化学式为C19H15N4FSO2).下列说法错误的是( )
| A. | M属于化合物 | B. | M由42个原子构成 | ||
| C. | M中氮氧原子个数比为2:1 | D. | M由六种元素组成 |
20.下列实验操作中,正确的是( )
| A. |  给液体加热 | B. |  放入铁钉 | C. |  检查气密性 | D. |  测溶液的酸碱度 |
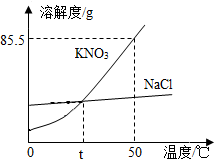 如图为KNO3、NaCl的溶解度曲线.
如图为KNO3、NaCl的溶解度曲线. 如图是初中化学中常见物质间的转化关系.
如图是初中化学中常见物质间的转化关系.