题目内容
14.写出下列反应的化学方程式,并在括号内注明基本反应类型:(1)木炭还原氧化铜C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑(置换反应)
(2)铝在空气中被氧化4Al+3O2═2Al2O3(化合反应)
(3)酒精在空气中燃烧C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O.
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写;再根据反应特征确定反应类型.
解答 解:(1)木炭还原氧化铜生成铜和二氧化碳,反应的化学方程式为:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应.
(2)铝在空气中被氧化生成氧化铝,反应的化学方程式为:4Al+3O2═2Al2O3;该反应符合“多变一”的特征,属于化合反应.
(3)酒精在空气中燃烧生成二氧化碳和水,反应的化学方程式为:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O.
故答案为:(1)C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;置换反应;(2)4Al+3O2═2Al2O3;化合反应;(3)C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O.
点评 本题难度不大,考查学生根据反应原理书写化学方程式、判定反应类型的能力,掌握化学方程式的书写方法(写、配、注、等)、四种基本反应类型的特征即可正确解答本题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.学习了二氧化锰对过氧化氢分解制取氧气有催化作用的知识后,某同学想CuO能否起到类似二氧化锰的催化剂作用呢?于是进行了以下探究:
【猜想】
A.CuO不是催化剂,也不参加反应,反应前后质量和化学性质都不变
B.CuO参与反应产生氧气,反应前后质量和化学性质都发生改变
C.CuO是这个反应的催化剂,反应前后质量和化学性质不变
【实验】
步骤1:用试管取少量过氧化氢溶液,将带火星的木条伸入试管中,观察现象.
步骤2:该同学将CuO放在天平的右盘进行称量,左盘的砝码为2g,游码的读数为0.8g.将称好的CuO倒入上述试管中,迅速将带火星的木条伸入试管内,观察现象.
步骤3:待步骤2试管中不再产生气泡,过滤将试管中的固体和液体分离开来,将得到的固体烘干,称量固体的质量.
步骤4:将步骤3得到的固体再加入到过氧化氢溶液中迅速将带火星的木条伸入试管中,观察现象.
(1)填写下表
(2)步骤1的目的是与步骤3对比,检验加入CuO前后双氧水分解速度有无变化.
(3)步骤3的目的是验证氧化铜化学反应前后的质量不变.
(4)请写出该实验的化学反应方程式2H2O2$\frac{\underline{\;CuO\;}}{\;}$2H2O+O2↑.
【猜想】
A.CuO不是催化剂,也不参加反应,反应前后质量和化学性质都不变
B.CuO参与反应产生氧气,反应前后质量和化学性质都发生改变
C.CuO是这个反应的催化剂,反应前后质量和化学性质不变
【实验】
步骤1:用试管取少量过氧化氢溶液,将带火星的木条伸入试管中,观察现象.
步骤2:该同学将CuO放在天平的右盘进行称量,左盘的砝码为2g,游码的读数为0.8g.将称好的CuO倒入上述试管中,迅速将带火星的木条伸入试管内,观察现象.
步骤3:待步骤2试管中不再产生气泡,过滤将试管中的固体和液体分离开来,将得到的固体烘干,称量固体的质量.
步骤4:将步骤3得到的固体再加入到过氧化氢溶液中迅速将带火星的木条伸入试管中,观察现象.
(1)填写下表
| 步骤1的现象 | 步骤2的结果 | 步骤4的现象 | 结论 |
| 产生大量气泡,带火星的木条复燃 | 固体的质量为 1.2g | 产生大量气泡,带火星的木条复燃 | 猜想A、B不成立,猜想C成立 |
(3)步骤3的目的是验证氧化铜化学反应前后的质量不变.
(4)请写出该实验的化学反应方程式2H2O2$\frac{\underline{\;CuO\;}}{\;}$2H2O+O2↑.
9.自来水是我国主要的生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容.
(1)感官指标表现的是自来水的物理性质(填“物理”或“化学”);
(2)自来水属于混合物(填“纯净物”或“混合物”); 自来水中的游离氯有少量可转变成氯离子,氯离子的符号是Cl-.
(5)检验水是硬水还是软水,可用的物质是肥皂水,生活中使硬水软化的常用方法是煮沸.
| 项目 | 标准 |
| 感官指标 | 无异味、异臭等 |
| 化学指标 | pH6.5-8.5,铜<1.0mg•L-1,铁<0.3mg•L-1,氟化物<1.0mg•L-1,游离氯≥0.3mg•L-1等 |
(2)自来水属于混合物(填“纯净物”或“混合物”); 自来水中的游离氯有少量可转变成氯离子,氯离子的符号是Cl-.
(5)检验水是硬水还是软水,可用的物质是肥皂水,生活中使硬水软化的常用方法是煮沸.
6.某化工厂用废硫酸制备K2SO4的流程如下:

(1)生产上将CaCO3研成粉末的目的是加快反应速率.
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是CaCO3(填写化学式).
(3)反应③中相关物质的溶解度如表所示.反应③在常温下 能实现的原因是常温下K2SO4的溶解度小.
(4)洗涤反应③所得晶体不用水而用饱不用填和K2SO4溶液的目的是减少K2SO4的溶解;
检验此晶体是否洗涤干净的方法是可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,目的是除去硫酸根,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净.

| 物质 | KCL | K2SO4 | NH4Cl | (NH4)2SO4 |
| 溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是CaCO3(填写化学式).
(3)反应③中相关物质的溶解度如表所示.反应③在常温下 能实现的原因是常温下K2SO4的溶解度小.
(4)洗涤反应③所得晶体不用水而用饱不用填和K2SO4溶液的目的是减少K2SO4的溶解;
检验此晶体是否洗涤干净的方法是可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,目的是除去硫酸根,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净.
4.下列物质的用途中,利用其物理性质的是( )
| A. | 二氧化碳供植物光合作用 | B. | 用氢气填充气球 | ||
| C. | 用液化石油气做燃料 | D. | 用氧气急救病人 |
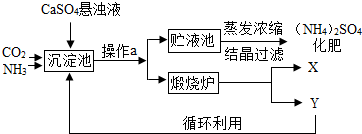 某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
