题目内容
在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线.

(2)根据曲线讨论溶液温度变化的原因.
①加入盐酸的量在0~10 mL时,________.
②加入盐酸的量在10~20 mL之间时,________.
(3)某同学提出“将氢氧化钠固体直接与10%的盐酸反应,以探究中和反应是否放热”,你认为它能否获得充分的证据?为什么?
答:________.
答案:
解析:
解析:
|
解:(1)如图,起点、最高点和终点等点表示要正确,曲线要光滑.绘制的曲线如下图.
(2)①随盐酸的量增加,中和反应放出热量增大,溶液温度上升.②中和反应完成后,过量盐酸起降温作用. (3)不能,因为固体氢氧化钠溶于水也要放热. 小结:(1)化学中的作图题一般用描点法,只要根据题给数据找到相应的点便可绘出曲线.其中关键点要准确,绘制的曲线要光滑. (2)解答问题应根据题给物质的具体特性作答. (3)有些物质溶于水或与水反应时,会放出热量.常见的有固体氢氧化钠、生石灰、浓硫酸等. 点拨:描绘曲线要注意关键点的位置要正确,曲线应光滑;利用曲线解答问题,应注意曲线的变化趋势,结合题给具体物质的特性作答. 误区突破:学生对化学反应中的热效应较为陌生,感到无从下手;忽略固体氢氧化钠溶于水放热这一现象. |

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数 .
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升 mL.
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
试在坐标系中绘出溶液温度变化与加入盐酸体积之间的变化关系图.
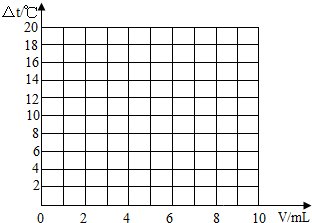
(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识. .
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |

(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识.


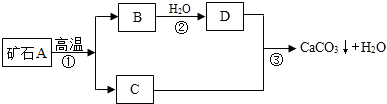
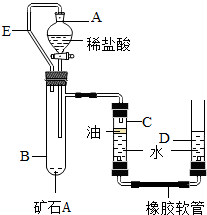 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.


