题目内容
等质量的两种金属
M和N分别与足量的稀硫酸反应,都生成+2价金属的硫酸盐和氢气.生成氢气的质量(纵坐标m( )与反应时间(横坐标t)的关系如下图,则据图可知,下列结论正确的是
)与反应时间(横坐标t)的关系如下图,则据图可知,下列结论正确的是
[
]
A
.相对原子质量金属M大于金属NB
.相对原子质量金属N大于金属MC
.金属M比N活泼D
.金属N比M活泼
答案:BC
解析:
解析:
|
解析:等质量的金属 M、N与足量稀 反应时,在单位时间里M产生的 反应时,在单位时间里M产生的 比N多,因此M的活动性比N强.换言之,等质量的M与N分别与足量酸恰好完全反应时,N用的时间长,M用的时间短,说明M比N活泼.当M、N反应完毕后,M产生 比N多,因此M的活动性比N强.换言之,等质量的M与N分别与足量酸恰好完全反应时,N用的时间长,M用的时间短,说明M比N活泼.当M、N反应完毕后,M产生 比N产生 比N产生 多,说明M的相对原子质量比N的相对原子质量小,所以B、C都正确. 多,说明M的相对原子质量比N的相对原子质量小,所以B、C都正确. |

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
 27、用下列仪器和试剂验证影响金属与盐酸反应速率的因素:烧杯、试管夹、酒精灯、药匙、量筒、天平.锌片、铁片、镁片.5%盐酸、20%盐酸.
27、用下列仪器和试剂验证影响金属与盐酸反应速率的因素:烧杯、试管夹、酒精灯、药匙、量筒、天平.锌片、铁片、镁片.5%盐酸、20%盐酸. 20、等质量的M、N两种金属,分别与相同质量分数、等质量的稀盐酸反应成生氢气质量和反应时间的关系如图所示.
20、等质量的M、N两种金属,分别与相同质量分数、等质量的稀盐酸反应成生氢气质量和反应时间的关系如图所示.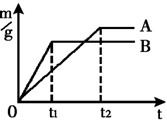
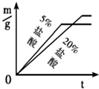 B.
B. C.
C.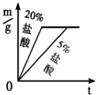 D.
D.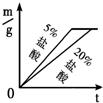
 金属材料用途广泛,回答下列问题:
金属材料用途广泛,回答下列问题: