题目内容
9.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式2NaOH+H2SO4═Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.不合理的理由是硫酸和氢氧化钠不能共存.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 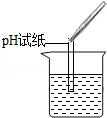 |  |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出
【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是把pH试纸伸入溶液中.
(2)实验方案中也有一个是错误的,错误的原因是错误是:利用氯化钡溶液检验硫酸;
错误原因是:即使溶液中不含有硫酸,硫酸钠也能够和氯化钡反应生成白色沉淀硫酸钡.
【拓展延伸】
(1)小燕同学在课后也做了该实验,但是她在滴加稀硫酸的过程中发现溶液中有少量气泡产生.这一“异常现象”激起了他们的探究欲望,通过实验证明:该同学用的这瓶氢氧化钠溶液已经部分变质.请用化学方程式表示其变质的原因:2NaOH+CO2═Na2CO3+H2O;产生气泡的反应方程式为:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;若要除去溶液中变质生成的杂质,请简要写出你的实验方案:向溶液中滴加氢氧化钙溶液,边滴加边振荡,直至不产生白色沉淀时停止滴加,过滤除去沉淀,得到氢氧化钠溶液.
(2)在演示实验中取10g氢氧化钠溶液放入烧杯中,当溶液的pH为7时消耗了20g9.8%的稀硫酸,则该氢氧化钠溶液的溶质质量分数为16%.
分析 【学生板演】
氢氧化钠和稀硫酸反应生成硫酸钠和水;
【实验探究】
氢氧化钠能和硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠;
稀硫酸显酸性,pH小于7;
碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳;
钡离子和硫酸根离子能够结合成白色沉淀硫酸钡;
【实验探究】
测定溶液酸碱度的方法是:用洁净干燥的玻璃棒蘸取溶液,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH;
【拓展延伸】
氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水;
碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
根据反应的化学方程式和提供的数据可以计算该氢氧化钠溶液的溶质质量分数.
解答 解:【学生板演】
氢氧化钠和稀硫酸反应生成硫酸钠和水,该反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O.
故填:2NaOH+H2SO4═Na2SO4+2H2O.
【假设猜想】
不合理的猜想是猜想四,不合理的理由是硫酸和氢氧化钠不能共存.
故填:猜想四;硫酸和氢氧化钠不能共存.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
故填:NaOH.
(2)实验过程如下表所示:
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生气泡 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(1)实验操作中的错误是把pH试纸伸入溶液中.
故填:把pH试纸伸入溶液中.
(2)实验方案中也有一个是错误的,错误的原因是:错误是:利用氯化钡溶液检验硫酸;
错误原因是:即使溶液中不含有硫酸,硫酸钠也能够和氯化钡反应生成白色沉淀硫酸钡.
故填:错误是:利用氯化钡溶液检验硫酸;
错误原因是:即使溶液中不含有硫酸,硫酸钠也能够和氯化钡反应生成白色沉淀硫酸钡.
【拓展延伸】
(1)氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式为:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
若要除去溶液中变质生成的杂质,请简要写出你的实验方案是:向溶液中滴加氢氧化钙溶液,边滴加边振荡,直至不产生白色沉淀时停止滴加,过滤除去沉淀,得到氢氧化钠溶液.
故填:2NaOH+CO2═Na2CO3+H2O;Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;向溶液中滴加氢氧化钙溶液,边滴加边振荡,直至不产生白色沉淀时停止滴加,过滤除去沉淀,得到氢氧化钠溶液.
(2)设氢氧化钠质量为x,
2NaOH+H2SO4═Na2SO4+2H2O,
80 98
x 20g×9.8%
$\frac{80}{x}$=$\frac{98}{20g×9.8%}$,
x=1.6g,
则该氢氧化钠溶液的溶质质量分数为:$\frac{1.6g}{10g}$×100%=16%.
故填:16%.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
20.小明同学对所学部分化学知识归纳如下,其中完全正确的一组是( )
| A.物质的分类 | B.用“化学”眼光分析 |
| ①玻璃、塑料都属于无机非金属材料 ②含碳的化合物都属于有机物 ③涤纶、羊毛和棉花属于天然纤维 | ①工业制汽水时,利用 加压的方法使大量的二氧化碳气体溶解在水里 ②地里庄稼出现叶色发黄需施用氮肥 ③装食品用的聚乙烯塑料袋可以通过加热进行封口 |
| C.“元素与健康”的关系 | D.物质的俗称、学名与化学式 |
| ①做菜时用铁强化酱油调味防治贫血 ②大米给人体提供的营养素是蛋白质 ③氟、铁、钠是人体所需的微量元素 | ①酒精 乙醇 C2H6O ②盐酸 氢氯酸 HCl ③铜绿 氢氧化铜 Cu2(OH)2CO3 |
| A. | A | B. | B | C. | C | D. | D |
4.在下列图示实验中,漏斗或导管口位置正确的是( )
| A. |  收集氢气 | B. |  收集滤液 | C. |  氢气还原氧化铜 | D. |  制取二氧化碳 |
14.我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案进行试验.
资料摘要:
Ⅰ.碳酸钠和氯化钙能发生复分解反应.
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
(1)分析滴加的CaCl2溶液要过量的原因:产生白色沉淀与碳酸钠充分反应;
(2)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.称得沉淀物的质量为10g
(已知 Na2CO3和CaCO3的相对分子质量分别为106和100),计算Na2CO3的质量分数为91.4%.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).

(3)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(4)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(5)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
资料摘要:
Ⅰ.碳酸钠和氯化钙能发生复分解反应.
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取11.6g纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式 Na2CO3+CaCl2═CaCO3↓+2NaCl |
(2)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.称得沉淀物的质量为10g
(已知 Na2CO3和CaCO3的相对分子质量分别为106和100),计算Na2CO3的质量分数为91.4%.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).

(3)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(4)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(5)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
18.小亮同学想通过实验探究某企业采用的氨碱法制得纯碱样品的成分及含量.
【提出问题1】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
①只含有Na2CO3;②含有Na2CO3和NaHCO3
【查阅资料】
(1)表中的现象I对应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)现象Ⅱ为有白色沉淀产生.
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成下列实验报告.
【实验反思】实验步骤①中,氯化钙溶液过量的目的是将碳酸钠全部除去
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,小亮设计了如图1装置,通过称量B装置的质量变化来 确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进人装置B的C02与NaOH 均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.
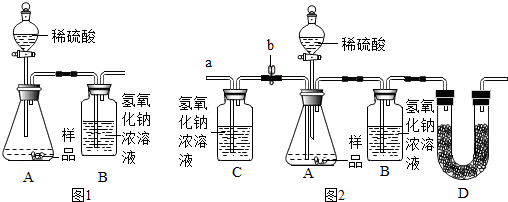
(2)小亮在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①检查装置气密性,将干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.
【提出问题1】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
①只含有Na2CO3;②含有Na2CO3和NaHCO3
【查阅资料】
| NaHCO3 | Na2CO3 | |
| 加入稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(2)现象Ⅱ为有白色沉淀产生.
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成下列实验报告.
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加入过量 的CaCl2溶液. | 有白色沉淀产生 | 该反应的方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液. | 有气泡冒出 | 证明猜想②成立. |
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,小亮设计了如图1装置,通过称量B装置的质量变化来 确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进人装置B的C02与NaOH 均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.

(2)小亮在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①检查装置气密性,将干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.