题目内容
26、写出下列物质或主要成分的化学式.
(1)氧化汞
(5)氢氧化铜
(1)氧化汞
HgO
,(2)硫化钠Na2S
,(3)乙酸CH3COOH
,(4)硫酸锌ZnSO4
,(5)氢氧化铜
Cu(OH)2
,(6)硝酸钾KNO3
,(7)大理石CaCO3
,(8)氯化铝AlCl3
.分析:化合物化学式的书写一般规律:先读后写,后读先写;金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,还要遵循化合价原则,即在化合物中正负化合价代数和为零.
解答:解:根据化学式书写方法可写出
(1)汞的化合价为+2价,氧的化合价为-2价,根据化合价规则氧化汞的化学式为:HgO;
(2)钠的化合价为+1价,硫的化合价为-2价,根据化合价规则硫化钠的化学式为:Na2S;
(3)根据有机物的书写规则乙酸的化学式为:CH3COOH;
(4)锌的化合价为+2价,硫酸根的化合价为-2价,根据化合价规则硫酸锌的化学式为:ZnSO4;
(5)铜的化合价为+2价,氢氧根的化合价为-1价,根据化合价规则氢氧化铜的化学式为:Cu(OH)2;
(6)钾的化合价为+1价,硝酸根的化合价为-1价,根据化合价规则硝酸钾的化学式为:KNO3
(7)钙的化合价为+2价,碳酸根的化合价为-2价,根据化合价规则大理石的化学式为:CaCO3;
(8)铝的化合价为+3价,氯的化合价为-1价,根据化合价规则氯化铝的化学式为:AlCl3
故答案为:(1)HgO;(2)Na2S;(3)CH3COOH;(4)ZnSO4;
(5)Cu(OH)2;(6)KNO3;(7)CaCO3;(8)AlCl3;
(1)汞的化合价为+2价,氧的化合价为-2价,根据化合价规则氧化汞的化学式为:HgO;
(2)钠的化合价为+1价,硫的化合价为-2价,根据化合价规则硫化钠的化学式为:Na2S;
(3)根据有机物的书写规则乙酸的化学式为:CH3COOH;
(4)锌的化合价为+2价,硫酸根的化合价为-2价,根据化合价规则硫酸锌的化学式为:ZnSO4;
(5)铜的化合价为+2价,氢氧根的化合价为-1价,根据化合价规则氢氧化铜的化学式为:Cu(OH)2;
(6)钾的化合价为+1价,硝酸根的化合价为-1价,根据化合价规则硝酸钾的化学式为:KNO3
(7)钙的化合价为+2价,碳酸根的化合价为-2价,根据化合价规则大理石的化学式为:CaCO3;
(8)铝的化合价为+3价,氯的化合价为-1价,根据化合价规则氯化铝的化学式为:AlCl3
故答案为:(1)HgO;(2)Na2S;(3)CH3COOH;(4)ZnSO4;
(5)Cu(OH)2;(6)KNO3;(7)CaCO3;(8)AlCl3;
点评:化学式的写法和读法往往结合起来一块考查,学生需留心,掌握基本规律.

练习册系列答案
相关题目
同学们在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.
[提出问题]盛放NaOH溶液的试剂瓶瓶口的白色粉末究竟是什么物质?
[查阅资料](1)已知玻璃的主要成分是二氧化硅(Si02),它具能与CO2、SO2相似的化学性质,与氢氧化钠反应产生的硅酸钠(Na2SiO3)和水,硅酸钠也是一种白色固体,俗称“水玻璃”,它是一种凝胶,能将玻璃粘结在一起;
(2)硅酸钠和盐酸或硫酸能发生复分解反应,产生的硅酸(H2SiO3)是一种白色难溶解于水的固体.
[成分分析]同学们依据所学的化学知识结合从资料中获取的信息,对这种白色粉末的成分作了如下猜想:
①小军可能是Na2CO3和Na2SiO3的混合物;
②小红可能是NaOH、Na2CO3和Na2SiO3的混合物.
[实验验证]为了验证猜想,小红同学取少量上述白色粉末并完全溶于水,用pH试纸测得溶液的pH大于7,继续向溶液中滴加稀盐酸至过量,发现有气体生成,同时还有白色沉淀出现.由此小红认为自己的猜想成立.
(1)写出下列有关化学反应的化学方程式:
①二氧化硅(Si02)和氢氧化钠溶液的反应________;
②小红的实验中,白色沉淀形成的化学反应________.
[问题解答]
(2)实验室里不同化学试剂的保存方法不尽相同.现有①NaOH溶液、②硝酸银溶液、③大理石、④白磷、⑤稀硫酸等5种药品可分别保存在下列各试剂瓶中,请把NaOH溶液和硝酸银溶液的序号填写在各试剂瓶下面的括号内:
| A | B | C | D | E |
 |  |  |  |  |
[含量测定]在老师的指导下,同学们设计了实验并通过实验证明小军的猜想成立.为进一步确定白色粉末中碳酸钠的质量分数,他们设计了如下2种不同的实验方案:
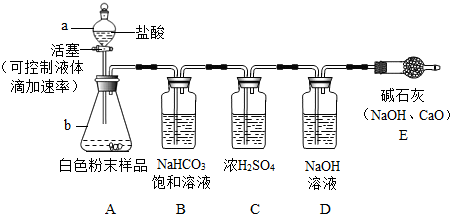
方案一:气体分析法--取2.5g白色粉末样品,放入锥形瓶(见下图),加入足量的盐酸充分反应,气体最后通入氢氧化钠溶液(假设气体全部被氢氧化钠吸收,忽略系统内空气中CO2的影响),两次称量盛氢氧化钠溶液的洗气瓶的质量,得前后两次质量差为0.90g.

[实验讨论]
①向锥形瓶加入白色粉末样品前,必须进行的操作是________;
②装置E的作用是________;
③用B中NaHCO3饱和溶液除去CO2中混有的少量HCl气体,B中的NaHCO3溶液能否换成石灰水?请判断并写出理由________.
④老师和同学们都认为:不能根据以上实验数据0.90g计算白色粉末中碳酸钠的质量分数,理由是________;
⑤为达到准确测定白色粉末样品中碳酸钠的质量分数的目的,应该加以改进,你认为改进方法是________.
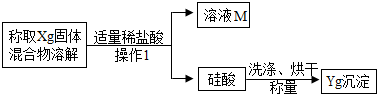
方案二:沉淀分析法--另取一定量白色粉末的样品,按照下图所示的过程进行实验,测定产生的硅酸的质量以推算碳酸钠的质量分数.

(1)“操作1”的名称是_________;
(2)确定盐酸是否适量的方法是________(说明实验的操作、现象与结论);
(3)若实验中所取样品的质量为3g,产生硅酸沉淀的质量为0.39g.计算该白色粉末中碳酸钠的质量分数.
[反思评价]导致测定的结果偏大的原因可能是________.
 (2012?道外区二模)化学课上,李老师在积木(三角块或长方形)上标上不同字母,每个字母代表氧气、稀硫酸、硫酸铜溶液、细铁丝(无锈)、氢氧化钠溶液中的一种物质,并将积木搭成房子(如图),要求相邻的积木上标注的物质间在一定条件下能发生反应,且C与E物质反应无明显现象,请你参与下列游戏:
(2012?道外区二模)化学课上,李老师在积木(三角块或长方形)上标上不同字母,每个字母代表氧气、稀硫酸、硫酸铜溶液、细铁丝(无锈)、氢氧化钠溶液中的一种物质,并将积木搭成房子(如图),要求相邻的积木上标注的物质间在一定条件下能发生反应,且C与E物质反应无明显现象,请你参与下列游戏:


 化学课上,李老师在积木(三角块或长方形)上标上不同字母,每个字母代表氧气、稀硫酸、硫酸铜溶液、细铁丝(无锈)、氢氧化钠溶液中的一种物质,并将积木搭成房子(如图),要求相邻的积木上标注的物质间在一定条件下能发生反应,且C与E物质反应无明显现象,请你参与下列游戏:
化学课上,李老师在积木(三角块或长方形)上标上不同字母,每个字母代表氧气、稀硫酸、硫酸铜溶液、细铁丝(无锈)、氢氧化钠溶液中的一种物质,并将积木搭成房子(如图),要求相邻的积木上标注的物质间在一定条件下能发生反应,且C与E物质反应无明显现象,请你参与下列游戏: