题目内容
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.
(1)现有下列六种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2.
按照不同的分类标准,它们中有一种物质与其他物质有明显的不同,请找出这种物质,并写出分类的依据.(至少要写出两种分类方法)
① ;
② .
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应,Na2O2与水反应的离子方程式是 .从反应中 可以将化学反应分为氧化还原反应和非氧化还原反应,从上述氧化物中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式: 、 .
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间存在着一定的关系.请用简单的图示方法表示二者之间的关系: .用离子反应方程式证明你的观点: ; .
(1)现有下列六种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2.
按照不同的分类标准,它们中有一种物质与其他物质有明显的不同,请找出这种物质,并写出分类的依据.(至少要写出两种分类方法)
①
②
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应,Na2O2与水反应的离子方程式是
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间存在着一定的关系.请用简单的图示方法表示二者之间的关系:
考点:物质的简单分类,氧化反应,还原反应,书写化学方程式、文字表达式、电离方程式
专题:化学反应的基本类型和能量变化,物质的分类
分析:(1)①根据物质的类别或是化合物中氧元素的化合价来分类;
②根据化合物在常温下的状态进行分类;
(2)氧化还原反应中存在元素化合价的变化,根据物质的性质结合氧化还原反应和非氧化还原反应的特征来书写方程式;
(3)离子反应有的是氧化还原反应,有的不是氧化还原反应.
②根据化合物在常温下的状态进行分类;
(2)氧化还原反应中存在元素化合价的变化,根据物质的性质结合氧化还原反应和非氧化还原反应的特征来书写方程式;
(3)离子反应有的是氧化还原反应,有的不是氧化还原反应.
解答:解:(1)①根据氧元素的化合价来分类,在SO2、SiO2、CaO、MgO、Fe2O3中氧元素的化合价是-2价,但是Na2O2中元元素是-1价,故答案为:Na2O2;根据物质的类别或是化合物中氧元素的化合价;
②根据化合物SiO2、CaO、MgO、Fe2O3、Na2O2在常温下的状态均为固态,只有SO2是气态,
故答案为:SO2;根据物质在常温下的状态;
(2)Na2O2与水反应的离子方程式是:2Na2O2+2H2O=4Na++4OH-+O2↑,在氧化还原反应中存在元素化合价的变化,在给定的物质中,碱性氧化物氧化钙和酸性氧化物二氧化硅的反SiO2+CaO=CaSiO3应属于非氧化还原反应,过氧化钠具有氧化性,可以和二氧化硫反应生成硫酸钠,即SO2+Na2O2=Na2SO4,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;是否存在元素化合价的变化;SiO2+CaO=CaSiO3;SO2+Na2O2=Na2SO4;
(3)离子反应有的是氧化还原反应,有的不是氧化还原反应,二者的关系可以用右图表示,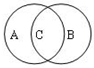
A代表氧化还原反应,B代表离子反应,其中的c代表即是氧化还原反应又是离子反应的化学反应,如离子反应H++OH-=H2O不属于氧化还原反应,离子反应Cl2+H2O=H++Cl-+HClO属于氧化还原反应,故答案为
;H++OH-=H2O;Cl2+H2O=H++Cl-+HClO.
②根据化合物SiO2、CaO、MgO、Fe2O3、Na2O2在常温下的状态均为固态,只有SO2是气态,
故答案为:SO2;根据物质在常温下的状态;
(2)Na2O2与水反应的离子方程式是:2Na2O2+2H2O=4Na++4OH-+O2↑,在氧化还原反应中存在元素化合价的变化,在给定的物质中,碱性氧化物氧化钙和酸性氧化物二氧化硅的反SiO2+CaO=CaSiO3应属于非氧化还原反应,过氧化钠具有氧化性,可以和二氧化硫反应生成硫酸钠,即SO2+Na2O2=Na2SO4,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;是否存在元素化合价的变化;SiO2+CaO=CaSiO3;SO2+Na2O2=Na2SO4;
(3)离子反应有的是氧化还原反应,有的不是氧化还原反应,二者的关系可以用右图表示,

A代表氧化还原反应,B代表离子反应,其中的c代表即是氧化还原反应又是离子反应的化学反应,如离子反应H++OH-=H2O不属于氧化还原反应,离子反应Cl2+H2O=H++Cl-+HClO属于氧化还原反应,故答案为

;H++OH-=H2O;Cl2+H2O=H++Cl-+HClO.
点评:该题考查了物质的分类以及氧化还原反应的特征方面的知识,该考点的基础性比较强,主要出现在选择题和填空题中.

练习册系列答案
相关题目
某物质在氧气中燃烧,火星四溅,生成黑色的固体,该物质是( )
| A、硫粉 | B、木炭 | C、红磷 | D、铁丝 |
下列物质中,前者属于混合物,后者属于纯净物的是( )
| A、纯净的盐酸,冰水混合物 |
| B、纯碱,消石灰 |
| C、加热高锰酸钾得到的气体,电解水得到的气体 |
| D、含铜80%的氧化铜,石灰石 |
在实验室的下列做法中,正确的是( )
| A、为了节约药品,用剩的药品应放回原瓶 |
| B、为了防止滴管里的液体流出来,取液后的滴管要倒置 |
| C、为了获得感性认识,可以触摸或品尝药品 |
| D、为了安全,加热液体时,试管口不能对着人 |
下列物质属于氧化物的是( )
| A、O2 |
| B、KClO3 |
| C、NaOH |
| D、CuO |


 ,该粒子是(“原子”“阳离子”或“阴离子”)
,该粒子是(“原子”“阳离子”或“阴离子”)