题目内容
8.电焊时会闻到一股异味,这是因为在放电条件下部分氧气转化成了臭氧(O3).这一过程可用化学方程式表示为:3O2$\frac{\underline{\;放电\;}}{\;}$2O3.下列有关说法中正确的是( )| A. | 发生的是物理变化 | B. | O3与O2的性质相同 | ||
| C. | O3的相对分子质量为48 | D. | 臭氧比氧气多一个氧原子 |
分析 根据物理变化与化学变化的本质区别:是否有新物质生成判断属于什么变化,氧气和臭氧化学性质相似,物理性质不同;相对分子质量为各个原子的相对原子质量之和;
解答 解:A、氧气由氧分子构成,臭氧是由臭氧分子构成,氧气与臭氧是两种不同的物质,所以该变化属于化学变化,故A说法错误;
B、O2与O3是氧元素的同素异形体,物理性质不同,化学性质相似,故B错误;
C、O3的相对分子质量=16×3═48,故C说法正确;
D、应该是臭氧分子比氧气分子多一个氧原子,故D说法错误.
故选C
点评 本题考查了化学变化的判断方法、分子的构成、性质和质量相关知识,系统性强,平时学习时要注意知识的前后联系.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
3.用氢氟酸对玻璃产品进行腐蚀雕刻的反应原理可表示为:SiO2+4HF═X↑+2H2O,则式中X的化学式为( )
| A. | SiF | B. | SiF4 | C. | SiH4 | D. | F4 |
17.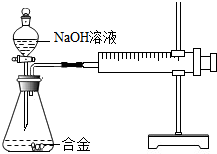 合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为:2AI+2NaOH+2H2O═2NaAIO2+3H2↑
(NaAlO2溶于水,溶液显无色)
进行猜想】猜想1:该合金粉末中除铝外,还含有铁
猜想2:该合金粉末中除铝外,还含有铜
猜想3:该合金粉末中除铝外,还含有铁、铜.
实验探究】下列实验(见表1)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液.
表1实验记录
【得出结论】猜想3成立.
【反思】
1.一般来说,活泼金属能与稀硫酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.铝与稀硫酸发生化学反应的化学方程式是2Al+3H2SO4═Al2(SO4)3+3H2↑
2.上述实验中用到的稀硫酸由浓硫酸稀释得到,稀释浓硫酸的方法是:把浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌.
3.若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是铜.
拓展与分析】为了比较铝、铁、铜的金属活动性强弱,某同学设计一个实验方案,将金属铝和铜插入到硫酸亚铁溶液中其现象是铝表面有一层红色物质出现,铜表面无现象.,说明铝、铁、铜金属活动性由弱到强顺序是铝>铁>铜.
 合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为:2AI+2NaOH+2H2O═2NaAIO2+3H2↑
(NaAlO2溶于水,溶液显无色)
进行猜想】猜想1:该合金粉末中除铝外,还含有铁
猜想2:该合金粉末中除铝外,还含有铜
猜想3:该合金粉末中除铝外,还含有铁、铜.
实验探究】下列实验(见表1)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液.
表1实验记录
| 实验步骤 | 实验现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%氢氧化钠溶液,充分反应后过滤,滤渣备用 | 粉末部分溶解,并有无色气体放出 | 合金中一定含有铝 |
| ②取步骤①所得滤渣,加过量20%的硫酸溶液,充分反应 | 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有铁、铜 |
【反思】
1.一般来说,活泼金属能与稀硫酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.铝与稀硫酸发生化学反应的化学方程式是2Al+3H2SO4═Al2(SO4)3+3H2↑
2.上述实验中用到的稀硫酸由浓硫酸稀释得到,稀释浓硫酸的方法是:把浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌.
3.若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是铜.
拓展与分析】为了比较铝、铁、铜的金属活动性强弱,某同学设计一个实验方案,将金属铝和铜插入到硫酸亚铁溶液中其现象是铝表面有一层红色物质出现,铜表面无现象.,说明铝、铁、铜金属活动性由弱到强顺序是铝>铁>铜.
18.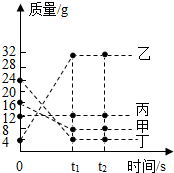 在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )
在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )
 在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )
在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )| A. | 乙物质一定是化合物 | |
| B. | 丙可能为该反应的催化剂 | |
| C. | 该反应中,乙、丁的质量变化之比为7:5 | |
| D. | 该反应中,甲、乙的质量变化之比为1:4 |
 如图是某化学反应的微观示意图,图中
如图是某化学反应的微观示意图,图中 、
、 和
和 分别为三种元素的原子.则下列说法中正确的是C
分别为三种元素的原子.则下列说法中正确的是C