题目内容
19.已知,在水溶液中,乙醇( C2H5OH )不发生电离;溴化氢(HBr)电离产生氢离子(H+)和溴离子(Br-);氢氧化钠电离产生钠离子和氢氧根离子.请回答下列问题:(1)根据这三种溶液的组成推断,医用酒精(含乙醇75%的水溶液)显中性,溴化氢的水溶液显酸性.
(2)写出上述物质之间发生反应的化学方程式HBr+NaOH═NaBr+H2O,恰好完全反应后溶液中存在的粒子有(用化学符号表示)Na+、Br-、H2O.
(3)迁移运用:胃酸过多的病人须服用抗酸药.下表为两种抗酸药的有效成分及其构成微粒:
| 抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
| 有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
| 构成微粒 | Mg2+、OH- | Al3+、Mg2+、OH-、CO32- |
Mg(OH)2起抗酸作用的微粒是OH-(填微粒符号,下同).
铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl=MgCl2+AlCl3+4H2O+CO2↑.铝碳酸镁起抗酸作用的两种微粒是OH-、CO32-.
分析 (1)根据在水溶液中电离出的阳离子全部是氢离子的化合物叫酸进行分析;
(2)根据氢氧化钠和氢溴酸反应生成溴化钠和水进行分析;
(3)根据酸碱中和反应、氢离子与碳酸根离子反应等方面进行分析.
解答 解:(1)由于酒精在水溶液中不发生电离,在它的溶液中也就没有氢离子或者是氢氧根离子,所以酒精溶液既不显酸性也不显碱性;而溴化氢能发生电离产生氢离子,因此它的水溶液呈酸性;
(2)由于溴化氢电离时生成的阳离子只有氢离子,说明它是酸,而氢氧化钠是碱,所以它们发生的反应是中和反应,化学方程式为:HBr+NaOH═NaBr+H2O,恰好完全反应后溶液中存在的粒子有:Na+、Br-、H2O;
(3)胃酸的主要成分为盐酸,Mg(OH)2中氢氧根离子能与胃酸中的盐酸中的氢离子发生中和反应生成水,从而起到中和胃酸的作用;
AlMg(OH)3CO3中的OH-、CO32-都能和胃酸中的氢离子反应.
故答案为:(1)中,酸;
(2)HBr+NaOH═NaBr+H2O,Na+、Br-、H2O;
(3)OH-;
OH-、CO32-.
点评 本题难度不是很大,主要考查了有关酸的化学性质及中和反应的应用,培养学生的理解能力和分析能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.某课外活动小组的同学在课外实践活动中,检测到我市安化县境内某溶洞中的流水中溶有较多量的Ca(HCO3)2.下列对该溶洞中的流水的说法不正确的是( )
| A. | 溶洞中的流水是硬水 | |
| B. | 取适量溶洞中的流水,加肥皂水时会出现较多浮渣 | |
| C. | 溶洞中的流水可作为优质饮用水 | |
| D. | 溶洞中的流水不宜直接洗衣服 |
7.某废旧金属中含有铜、金(Au)和镍(Ni),回收Au并制备CuSO4•5H2O晶体的流程如下:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 反应1的生成物为H2O | |
| B. | 操作1和操作2用到玻璃仪器为漏斗、烧杯和玻璃棒 | |
| C. | 三种金属的金属活动性顺序为:Cu>Ni>Au | |
| D. | 反应2的化学方程式为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O |
14.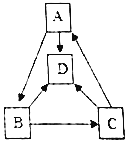 A、B、C、D四种物质之间的一步转化关系如图所示(部分反应物、生成物及反应条件未标出),它们均含有同种金属元素,A是石灰石的主要成分,B是氧化物,C为碱,D由两种元素组成.下列判断错误的是( )
A、B、C、D四种物质之间的一步转化关系如图所示(部分反应物、生成物及反应条件未标出),它们均含有同种金属元素,A是石灰石的主要成分,B是氧化物,C为碱,D由两种元素组成.下列判断错误的是( )
 A、B、C、D四种物质之间的一步转化关系如图所示(部分反应物、生成物及反应条件未标出),它们均含有同种金属元素,A是石灰石的主要成分,B是氧化物,C为碱,D由两种元素组成.下列判断错误的是( )
A、B、C、D四种物质之间的一步转化关系如图所示(部分反应物、生成物及反应条件未标出),它们均含有同种金属元素,A是石灰石的主要成分,B是氧化物,C为碱,D由两种元素组成.下列判断错误的是( )| A. | B可用来配制波尔多液 | |
| B. | D物质可能属于氧化物 | |
| C. | 图中未涉及的基本反应类型是置换反应 | |
| D. | D在一定条件下也可以转化为A |
11.分类法是化学学习的重要方法,下列说法正确的是( )
| A. | 常见的有机物:H2CO3、C2H6OH、CH2COOH | |
| B. | 常见的黑色固体:CuO、MnO2、Fe3O4 | |
| C. | 常见的氧化物:MgO、KMnO4、H2O | |
| D. | 常见的有还原性的物质:C、CO、O2 |
9.下列化学实验基本操作错误的是( )
| A. |  滴管用后插回原瓶 滴管用后插回原瓶 | B. |  加热液体 加热液体 | ||
| C. |  放入铁钉 放入铁钉 | D. |  称量固体 称量固体 |
 利用右图装置制取并测定所收集氢气的体积.毛毛同学在锥形瓶中装入13g锌粒,往长颈漏斗中加入100g稀硫酸,两者恰好完全反应.
利用右图装置制取并测定所收集氢气的体积.毛毛同学在锥形瓶中装入13g锌粒,往长颈漏斗中加入100g稀硫酸,两者恰好完全反应.
