题目内容
19.纳米碳酸钙是一种重要的无机化工产品,下图是某厂生产纳米碳酸钙的工艺流程. 请回答下列问题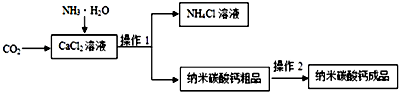
(1)请完成并配平该工艺中生成CaCO3固体的反应方程式:CaCl2+2NH3•H2O+CO2=CaCO3+2NH4Cl+H2O
(2)若在实验室中进行该实验,操作l的名称是过滤,使用到的玻璃实验用品有:玻璃棒、漏斗、烧杯; 操作2为:加水清洗、检验和干燥,检验操作中选用的试剂为②.(选择序号)①NH4Cl溶液 ②AgNO3溶液 ③CaCl2溶液 ④Ba(NO3)2溶液
(3)上述流程中的副产品(NH4Cl)可用作氮肥(化肥、肥料) (写一种用途).NH4Cl与NaOH溶液混合微热,产生的气体能使湿润的红色石蕊试纸变蓝色.施用该肥料时,要避免与碱性(填“酸性”或“碱性”)物质混合使用,以免产生氨气,降低肥效.
分析 (1)根据方程式的写法考虑;(2)根据液体与固体分离的方法考虑,根据过滤操作用到的仪器考虑玻璃仪器;根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑;(3)根据副产品的组成和用途考虑.
解答 解:(1)生成CaCO3固体的反应物是氯化钙、氨水、二氧化碳,生成物是碳酸钙、氯化铵和水,用观察法配平,碳酸钙后面标上沉淀符号;
(2)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,过滤用到的仪器有:铁架台、漏斗、烧杯、玻璃棒,所以玻璃仪器有:漏斗、烧杯、玻璃棒;由于碳酸钙粗品是从氯化钙溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;把碳酸钙粗品表面含有的可溶性杂质氯化铵除掉的方法是用水清洗,检验是否还含有氯化铵,可以利用检验氯离子,使用硝酸银,硝酸银能与氯化铵反应生成氯化银沉淀,有沉淀说明没除净,没有沉淀说明除净了;
(3)流程中的副产品是氯化铵,氯化铵属于氮肥,可以做肥料,氯化铵与氢氧化钠反应产生氨气,显碱性,能使红色石蕊试纸变蓝;铵态氮肥不能和碱性肥料混合使用,否则会产生氨气,降低肥效.
故答案为:(1)2NH3•H2O;2NH4Cl;(2)过滤; 玻璃棒;漏斗;加水清洗;②;(3)氮肥(化肥、肥料);蓝;碱性;产生氨气,降低肥效.
点评 解答本题关键是要熟悉方程式的写法,过滤操作能达到的目的,熟悉过滤操作中使用的仪器,知道氯离子的检验方法和氯化铵的用途.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
10.物质X可发生“X+酸→盐+H2O”的反应,则X可能是( )
| A. | Fe | B. | CO2 | C. | CuSO4 | D. | NaOH |
14.氧化铁和氧化铜的固体混合粉末X克,高温下用足量的CO还原,得到金属混合物2.4克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5克白色沉淀,则原固体混合粉末中氧化铁与氧化铜的质量比为( )
| A. | 4:1 | B. | 2:3 | C. | 1:2 | D. | 1:1 |
9.区别下列各组物质,选用的方法或试剂正确的是C:
| 物 质 | 选用的方法或试剂 | |
| A | 二氧化碳和氮气 | 燃着的木条 |
| B | 二氧化锰和木炭 | 看颜色 |
| C | 氧气和二氧化碳 | 通入澄清石灰水 |
| D | 硬水和软水 | 加入肥皂水 |
 过滤是除去液体中不溶性固体的一种方法.利用它可将不溶于液体的固体和液体进行分离.
过滤是除去液体中不溶性固体的一种方法.利用它可将不溶于液体的固体和液体进行分离.