题目内容
16.如图所示为实验室中常见气体制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器).试根据题目要求,回答下列问题:
(1)若用稀盐酸和碳酸钙为原料在实验室中制备并收集干燥的二氧化碳(不考虑盐
酸的挥发性).
①所选仪器的连接顺序为ADC (填写仪器序号字母);
②生成二氧化碳时,仪器A.中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)若用锌和稀硫酸反应制取氢气,并用来测定某不纯的氧化铜样品的纯度(杂质为少量单质铜),所选仪器的连接顺序为:A→D1→E→D2→D3.(已知:Cuo+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;D1、D2、D3为3个盛有浓硫酸的洗气瓶)
①仪器D1的作用是除去氢气中的水蒸气;
②实验过程中E装置内的现象是黑色粉末慢慢变成红色;
③充分反应后盛有浓硫酸洗气瓶D2的质量增加了9g,则E装置内固体质量减少了8g.
分析 (1)根据反应物的状态和反应条件确定实验室制取气体的发生装置,根据气体的密度和溶水性确定气体的收集装置,要得到干燥的二氧化碳,应在收集装置前面加一个干燥装置;熟记常用的化学方程式;
(2)根据浓硫酸的吸水性、反应的原理与实验现象、生成水的质量利用化学方程式进行计算.
解答 解:(1)实验室通常用稀盐酸与大理石反应制取二氧化碳,反应物的状态是固态和液态,反应条件是常温,应选固-液不加热型的发生装置;二氧化碳的密度比空气大,能溶于水,只能用向上排空气法收集;因为要收集到干燥的二氧化碳,所以应在收集装置前面加一个干燥装置,浓硫酸具有吸水性,可用来干燥二氧化碳,所以仪器的连接顺序为:ADC;碳酸钙和盐酸发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.故填:①ADC;②CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)①浓硫酸具有吸水性,可以吸收氢气中的水蒸气.故填:除去氢气中的水蒸气;
②在加热的条件下,氢气与氧化铜反应生成铜和水,所以观察到黑色粉末慢慢变成红色;故填:黑色粉末慢慢变成红色;
③洗气瓶D2的质量增加了9g,这就是氢气还原氧化铜后生成水的质量,设固体减少的质量为x,则
CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O 固体质量减少
80 64 18 80-64=16
9g x
$\frac{18}{16}=\frac{9g}{x}$
x=8g
故填:8.
点评 本考点主要考查了仪器的连接和气体的除杂和干燥,同时也考查了化学方程式的书写和有关的计算等,综合性比较强,本题能较好的考查学生分析、解决问题的能力.

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 100 g水中溶解了10 g食盐 | |
| B. | 100 g食盐溶液中溶解了10 g食盐 | |
| C. | 将10 g食盐溶解于90 g水中所得的溶液 | |
| D. | 将食盐、食盐水按1:10的质量比配成的溶液 |
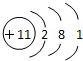
| A. | 原子核内有11个质子 | B. | 该粒子是阳离子 | ||
| C. | 在化学反应中易得电子 | D. | 该粒子属于金属元素 |
