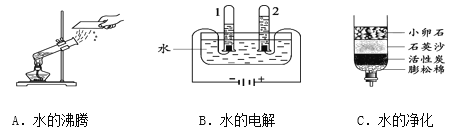
题目内容
【题目】已知A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈 黄色,A与C反应产生白色沉淀(微溶物不列为沉淀),它们相互间发生反应或转化 的关系如图所示(“﹣”表示两种物质间能发生反应,“→”表示两种物质间的转化 关系,部分反应物、生成物和反应条件已经略去).

(1)A、F的化学式分别为_____,_____;
(2)B与E反应的化学方程式为_____,其反应的基本反应类型为_____;G→D的化学方程式为_____;
(3)A→D反应的实验现象为_____.
【答案】Ba(OH)2 Fe2O3 Fe+CuSO4=FeSO4+Cu 置换反应 FeCl3+3NaOH=Fe(OH)3↓+3NaCl 有红褐色沉淀生成
【解析】
A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈黄色,A与C反应产生白色沉淀,所以G中含有铁离子,F会转化成G,所以F可以是氧化铁,F也会转化成E,所以E是铁,铁会与B反应,所以B可以是硫酸铜,C可以是硫酸,A是氢氧化钡,D是氢氧化铁,所以G可以是氯化铁,F氧化铁会转化成氯化铁、铁,会与硫酸反应,铁、氢氧化钡会与硫酸铜反应,硫酸会转化成硫酸铜,会与氢氧化钡、氢氧化铁反应,氢氧化钡、氯化铁都会转化成氢氧化铁,经过验证,推导正确,
(1)根据分析A是Ba(OH)2,F是Fe2O3;
(2)B与E的反应是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu,该反应属于置换反应,G→D的反应是氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,化学方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
(3)A→D的反应是氢氧化钡和氯化铁反应生成氢氧化铁沉淀和氯化钡,实验现象为:有红褐色沉淀生成。

【题目】在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。

(1)如图所示,探究稀硫酸和氢氧化钠溶液的反应。当在NaOH溶液中滴入几滴酚酞试液后,溶液由无色变为_____色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为_____。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量。根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
方案三 | 取样,_____ | _____ | 稀硫酸过量 |
①上述设计的实验方案中,正确的是_____(填“方案一”或“方案二”);
②另外一个实验方案错误的原因是_____。
③完成方案三中实验步骤和现象,填写到表格中。