题目内容
6.呼吸面具中制取氧气的主要原料是固体过氧化钠(Na2O2),某化学兴趣小组的同学为了测定呼吸面具中过氧化钠的质量分数,在老师的指导下,利用如图所示装置(固定装置一略去)开展探究.
已知,装置B 中盛有饱和NaHCO3 溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO 组成的混合物.整套装置气密性良好,反应所需试剂均足量. 2Na2O2+2CO2═2Na2CO3+O2
相关实验数据如下:
| Na2O2样品的质量/g | D反应前物质的质量/g | D反应后物质的质量/g |
| 40g | 222g | 236g |
(2)根据以上数据计算该样品的纯度.
分析 (1)根据过氧化钠会与二氧化碳和水蒸气反应进行分析;
(2)根据过氧化钠和二氧化碳反应生成碳酸钠和氧气,依据固体增加的质量计算参加反应的过氧化钠的质量,然后计算质量分数.
解答 解:(1)过氧化钠会与二氧化碳和水蒸气反应,本装置中主要是利用二氧化碳和过氧化钠的反应来计算的,所以装置E的作用为:防止空气中的水蒸气、二氧化碳与过氧化钠反应;
(2)设参加反应的过氧化钠的质量为x
2Na2O2+2CO2═2Na2CO3+O2,固体增加的质量
156 212 64
x 14g
$\frac{150}{x}$=$\frac{64}{14g}$
x=10.3g
所以样品的纯度是$\frac{10.3g}{40g}$×100%=25.6%.
故答案为:(1)防止空气中的水蒸气、二氧化碳与过氧化钠反应;
(2)25.6%.
点评 本题主要考查了质量守恒定律在化学计算中的应用,难度不大,注意解题的规范性和准确性.

练习册系列答案
相关题目
14.如图A为周期表中的镉元素,图B为镉原子结构示意图,下列说法正确的是( )


| A. | 镉原子的相对原子质量为112.4g | |
| B. | 镉位于周期表的第五周期,图B中X=4 | |
| C. | 金属镉是人体必需的微量元素 | |
| D. | 符号“Cd”表示金属镉、一个镉原子 |
1.下列说法或做法正确的是( )
| A. | 只要外界条件足够,所有物质都能燃烧 | |
| B. | 煤、石油、沼气、风能等都是可再生能源 | |
| C. | 用灯帽盖灭酒精灯的灭火原理是隔绝空气 | |
| D. | 图书档案着火,最好用干粉灭火器灭火 |
11.清明节假期,小明和父母到龙虎山参观游览,感受大自然的美.请你用学过的化学知识解决他们在游览中遇到的问题.
(1)他们进入景区大门,场地上各种鲜花盛开,香气扑鼻,用分子观点解释闻到花香的原因分子是不断运动的,他们看到员工正在给花草施用化肥硝酸钾,小明给父母解释施用的化肥中含有植物需要量较大的营养元素是N、K(填元素符号).
(2)他们在山顶进行了简单的午餐,下面的食品主要补充维生素的是C.
A.面包 B.香肠 C.苹果 D.高钙牛奶
(3)返回下山途中,小明拾取了一些游客乱扔的物品,其中属于金属材料的是B.
A.矿泉水瓶 B.易拉罐 C.塑料袋 D.门票及导游图
(4)小明用空瓶装了一瓶山泉水带回实验室,与同学们分享.请设计一个实验检验山泉水是硬水还是软水.
(5)对山泉水进行净化提纯,其净化程度最高的方法是B.
A.过滤 B.蒸馏 C.沉淀 D.吸附.
(1)他们进入景区大门,场地上各种鲜花盛开,香气扑鼻,用分子观点解释闻到花香的原因分子是不断运动的,他们看到员工正在给花草施用化肥硝酸钾,小明给父母解释施用的化肥中含有植物需要量较大的营养元素是N、K(填元素符号).
(2)他们在山顶进行了简单的午餐,下面的食品主要补充维生素的是C.
A.面包 B.香肠 C.苹果 D.高钙牛奶
(3)返回下山途中,小明拾取了一些游客乱扔的物品,其中属于金属材料的是B.
A.矿泉水瓶 B.易拉罐 C.塑料袋 D.门票及导游图
(4)小明用空瓶装了一瓶山泉水带回实验室,与同学们分享.请设计一个实验检验山泉水是硬水还是软水.
| 方法 | 现象 | 结论 |
| 取一定量的水样,加入一定量肥皂水振荡 | 浮渣多,泡沫少 | 此水为硬水 |
A.过滤 B.蒸馏 C.沉淀 D.吸附.
15.下列物质的溶液,需要另加试剂才能鉴别出来的一组是( )
| A. | CuSO4 BaCl2 H2SO4 | B. | Na2CO3 Ca(NO3)2 HCl | ||
| C. | Na2SO4 KNO3 HCl | D. | FeCl2 NaOH KMnO4 |
16.硒对人体有防癌、抗癌作用,如图1是硒元素在元素周期表中的部分信息,图2是硒原子的结构示意图,下列说法错误的是( )
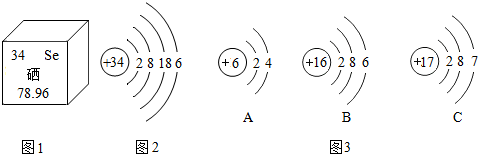

| A. | 硒是人体必需的微量元素 | |
| B. | 由图1可知,硒元素的相对原子质量是78.96 | |
| C. | 图3中A、B、C三种元素中与硒元素化学性质相似的是A元素 | |
| D. | 图3中C元素原子在化学反应中容易得到电子 |

