题目内容
15.请根据常见金属的活动性顺序回答:(1)将黄铜(铜锌合金)片和纯铜片分别放入稀盐酸中能产生气泡的是黄铜;
(2)使用下列各组试剂,一次性实验能验证Fe、Cu、Ag活动性顺序的是C
A.Ag、FeSO4溶液、CuSO4溶液
B.Fe、Cu、AgNO3溶液
C.Fe、Ag、CuSO4溶液.
D.Fe、CuSO4溶液、AgNO3溶液.
分析 (1)根据锌会与盐酸反应生成氢气进行分析;
(2)判断金属活动性顺序的基本方法有两种,一是通过金属与酸反应,二是通过金属与盐溶液反应.先根据现象判断是否反应,根据反应情况判断金属活动性,最后进行综合得出结论.
解答 解:(1)由于锌会与盐酸反应生成氢气,所以将黄铜(铜锌合金)片和纯铜片分别放入稀盐酸中能产生气泡的是黄铜片;
(2)A、由于Ag与FeSO4溶液、CuSO4溶液两溶液均不能发生反应,因此,只能得到Ag的活动性小于Fe、小于Cu的结论,却不能说明Fe与Cu两金属活动性强弱,故A不正确;
B、Fe、Cu都能与AgNO3溶液反应,说明Fe、Cu的金属活动性大于银,但不能比较Fe、Cu的活泼性的大小,所以不正确;
C、铁能置换出硫酸铜中的铜,得出金属活动性铁大于铜,银不能置换出硫酸铜中的铜,得出金属活动性铜大于银,一次性实验能验证Fe、Cu、Ag活动性顺序,所以正确.
D、Fe和CuSO4溶液、AgNO3溶液均可发生反应,说明Fe>Cu,Fe>Ag.而Cu和Ag无法比较,所以不正确.
故答为:(1)黄铜片;(2)C.
点评 掌握金属活动性顺序的判断思路和方法,恰当运用对比的分析方法是解题的前提.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
6.某科技兴趣小组同学为了测定某种黄铜(铜和锌的合金)的组成,取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如表:
(1)该黄铜样品中铜的质量是67.5克.
(2)第2次测得剩余固体质量为74g,其成分为C.
A.铜B.锌C.铜和锌
(3)实验所用的稀硫酸的质量分数多大?
(4)第3次加入稀硫酸充分反应后所得溶液的溶质是硫酸锌和硫酸;.
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
(2)第2次测得剩余固体质量为74g,其成分为C.
A.铜B.锌C.铜和锌
(3)实验所用的稀硫酸的质量分数多大?
(4)第3次加入稀硫酸充分反应后所得溶液的溶质是硫酸锌和硫酸;.
7.如图所示的实验操作中,不正确的是( )
| A. |  测定溶液PH值 测定溶液PH值 | B. |  检查装置气密性 | C. |  液体加热 | D. |  稀释浓硫酸 |
4.下列物质能由金属和酸直接反应制得的是( )
| A. | CuSO4 | B. | FeCl3 | C. | ZnSO4 | D. | HgCl2 |
 等质量的铁粉和锌粉,加入足量等浓度的稀硫酸中,不考虑浓度和温度等对反应速度的影响,请你在图中画出产生氢气的质量与时间关系的大致图象,并说明理由.
等质量的铁粉和锌粉,加入足量等浓度的稀硫酸中,不考虑浓度和温度等对反应速度的影响,请你在图中画出产生氢气的质量与时间关系的大致图象,并说明理由.
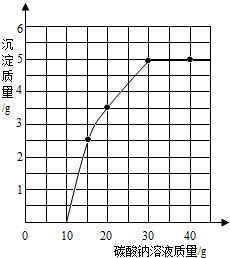 实验室用过量的稀盐酸和大理石制CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.回答下列问题:
实验室用过量的稀盐酸和大理石制CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.回答下列问题: