题目内容
2.(1)煤燃烧会释放出SO2等污染物,这些气体在空气中反应后的生成物溶于雨水,形成酸雨,酸雨对下列物品有损害的是ABD(填字母序号);A、大理石塑像 B、玻璃 C、花草树木(2)要想把上题中的SO2变废为宝,可把二氧化硫尾气、石灰石、空气、碳酸氢铵、氨气和 氯化钾等为原料可以合成有重要应用价值的硫酸钾等物质.合成流程如图所示:
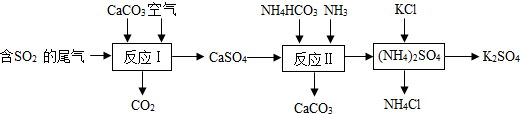
①写出反应II的总反应的化学方程式:CaSO4+NH4HCO3+NH3═CaCO3↓+(NH4)2SO4;
②上述流程中可循环使用的物质是CaCO3;
③反应II的温度需控制在60~70℃,其理由是防止NH4HCO3受热分解;
④上述流程中的副产物NH4Cl可做氮肥(写出在农业生产中的一种用途).
分析 (1)根据酸雨的危害进行解答;
(2)根据方程式的写法考虑;根据反应物中和生成物中都有的物质考虑.
解答 解:(1)酸雨对植物、大理石建筑和金属材料危害严重;
(2)①反应物是CaSO4、NH4HCO3、NH3生成物是CaCO3和(NH4)2SO4,碳酸钙后面标上沉淀符号.
②由图示可知反应物有二氧化硫、碳酸钙、空气;反应过程中生成物有:二氧化碳、硫酸钙、碳酸钙、氯化铵、硫酸钾,所以在反应物中和生成物中都有的物质是碳酸钙,所以流程中可循环使用的物质是碳酸钙;
③碳酸氢钠受热易分解,为防止NH4HCO3受热分解,所以反应Ⅱ的温度需控制在60~70℃;
④上述流程中的副产物NH4Cl可做氮肥.
故答案为:
(1)ABD;
(3)①CaSO4+NH4HCO3+NH3═CaCO3↓+(NH4)2SO4;②CaCO3; ③防止NH4HCO3受热分解;④氮肥
点评 本题难度不大,掌握常见化学物质的性质和用途、理解并能灵活运用质量守恒定律、根据微观示意图正确判断所涉及分子的构成是正确解答本题的关键.

练习册系列答案
相关题目
10.据报道,药物扎那米韦(化学式为C12H20N4O7)对人感染H7N9禽流感病毒治疗有效.下列有关扎那米韦的说法不正确的是( )
| A. | 扎那米韦属于有机高分子化合物 | |
| B. | 扎那米韦的相对分子质量为332 | |
| C. | 1个扎那米韦分子由12个碳原子、20个氢原子、4个氮原子和7个氧原子构成 | |
| D. | 扎那米韦中碳元素、氢元素和氮元素的质量比为3:5:1 |
17.下列物品材料为有机合成材料的是( )
| A. | 塑料玩具 | B. | 纯棉帽子 | C. | 陶瓷餐具 | D. | 玻璃钢 |
7.2013年5月4日,国内外各大媒体曝光:山东潍坊生姜种植户在种植内销的生姜时使用了一种叫“神农丹”的剧毒农药,“神农丹”所含物质的化学式为C7H14N2O2S,下列有关物质的说法不正确的是( )
| A. | 该物质由五种元素组成 | |
| B. | 该物质的一个分子中含碳氢原子个数比为1:2 | |
| C. | 该物质燃烧时可能会产生形成酸雨的物质 | |
| D. | 该物质属于氧化物 |
14.为了发展宁夏的煤炭资源优势,在宁东化工基地建设“煤变油”的二甲醚(化学式为C2H6O)生产线,下列关于二甲醚的说法中正确的是( )
| A. | 是一种氧化物 | |
| B. | 是由碳、氢、氧三种元素组成 | |
| C. | 相对分子质量为45 | |
| D. | 碳、氢、氧三种元素的质量比为2:6:1 |
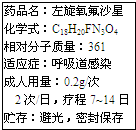 新药左旋氧氟沙星(C3H8FN2O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图.
新药左旋氧氟沙星(C3H8FN2O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图. 我们的衣食住行与化学知识密不可分.请根据下列生活中的事实填空.
我们的衣食住行与化学知识密不可分.请根据下列生活中的事实填空.