题目内容
14.下面和空气混合后不可能发生爆炸的是( )| A. | 面粉 | B. | 天然气 | C. | 氮气 | D. | 汽油 |
分析 爆炸是指在有限的空间里,化学反应中放出大量的热,生成大量的气体从而发生爆炸.可以根据爆炸原理进行正确的解答,物质和空气混合后遇到明火,则物质具有可燃性.
解答 解:A、面粉粉尘是可燃物,与空气混合遇到明火可能发生爆炸;
B、天然气是可燃性气体,与空气混合,遇明火可能发生爆炸;
C、氮气不是可燃物,与空气混合遇到明火也不发生爆炸;
D、汽油是可燃性液体,与空气混合遇明火可能发生爆炸;
故选C.
点评 本题主要考查了可燃物与空气混合遇明火是否爆炸的内容,可以依据物质的性质进行.

练习册系列答案
相关题目
4. 酸、碱是日常生活和实验中常用的两类物质.
酸、碱是日常生活和实验中常用的两类物质.
(1)硫酸是化学实验中常备的试剂,从化工商店买回来的一般是浓硫酸,某浓硫酸标签上的部分内容如图所示.如果要配制1kg10%的稀硫酸,需要这种浓硫酸的体积约为54.3mL(结果精确到0.1mL).配制稀硫酸时,正确的操作是先将量取的900mL水倒入烧杯中,然后将量取的54.3mL浓硫酸沿着烧杯壁慢慢注入水中,并不断的用玻璃棒进行搅拌.(2)氢氧化钠是一种常见的碱,俗名苛性钠、火碱或烧碱.请写出一条氢氧化钠在工业上的用途造纸、纺织、制肥皂等.
(3)为探究“酸碱中和反应”,某班同学进行了如下实验,将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
【提出问题】实验中无明显现象反应后溶液中的溶质是什么?
【做出猜想】①只有Na2SO4;②Na2SO4和H2SO4;③Na2SO4和NaOH;④Na2SO4、H2SO4和NaOH
不合理的猜想是④.
【实验探究】取烧杯中的溶液于试管中,滴加CuSO4溶液后无明显变化,则溶液中一定没有NaOH,为了验证其余猜想,同学们进行了如下三个实验方案的探究:
【结论与反思】通过探究,可确定猜想②是正确的,请指出以上实验探究中存在的两处错误pH试纸浸入溶液中,BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
(4)完全中和溶质质量分数为5%的氢氧化钠溶液16g,需溶质质量分数为4.9%的稀硫酸多少克?
 酸、碱是日常生活和实验中常用的两类物质.
酸、碱是日常生活和实验中常用的两类物质.(1)硫酸是化学实验中常备的试剂,从化工商店买回来的一般是浓硫酸,某浓硫酸标签上的部分内容如图所示.如果要配制1kg10%的稀硫酸,需要这种浓硫酸的体积约为54.3mL(结果精确到0.1mL).配制稀硫酸时,正确的操作是先将量取的900mL水倒入烧杯中,然后将量取的54.3mL浓硫酸沿着烧杯壁慢慢注入水中,并不断的用玻璃棒进行搅拌.(2)氢氧化钠是一种常见的碱,俗名苛性钠、火碱或烧碱.请写出一条氢氧化钠在工业上的用途造纸、纺织、制肥皂等.
(3)为探究“酸碱中和反应”,某班同学进行了如下实验,将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
【提出问题】实验中无明显现象反应后溶液中的溶质是什么?
【做出猜想】①只有Na2SO4;②Na2SO4和H2SO4;③Na2SO4和NaOH;④Na2SO4、H2SO4和NaOH
不合理的猜想是④.
【实验探究】取烧杯中的溶液于试管中,滴加CuSO4溶液后无明显变化,则溶液中一定没有NaOH,为了验证其余猜想,同学们进行了如下三个实验方案的探究:
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对比标准比色卡:pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(4)完全中和溶质质量分数为5%的氢氧化钠溶液16g,需溶质质量分数为4.9%的稀硫酸多少克?
9.下列物质的认识正确的是( )
| A. | 某专家称能“水变油”“点石成金” | |
| B. | 吸烟对青少年生长发育无害 | |
| C. | 生活中使用天然气做饭要通风透气 | |
| D. | 被毒鼠强药死的鸭水,煮熟后可以食用 |
4.毕倭寇同学想通过实验,探究某企业用氨碱法生产纯碱样品的成分及含量.
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,毕倭寇同学做出如下假设:(1)只含有Na2CO3;(2)含有Na2CO3和 NaHCO3【查阅资料】
(1)表中的现象I为产生气泡;
(2)现象Ⅱ对应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【实验探究】为了确定纯碱样品的成分,毕倭寇同学设计如下实验方案,请你一起完成下列实验报告.
【实验反思】实验步骤A中,氯化钙溶液过量的目的是将碳酸钠全部除去.
【提出问题2】如何测量该纯碱样品中各物质的含量?
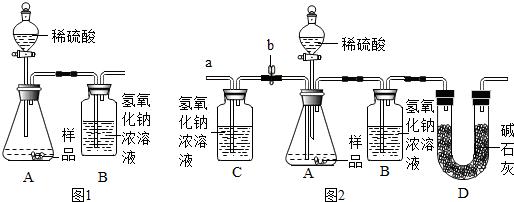
(1)为测量该纯碱样品各成分的含量,毕倭寇同学设了图1装置,通过称量B装置中质量变化来确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.
(2)毕倭寇同学在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①查装置气密性,将Wg干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,毕倭寇同学做出如下假设:(1)只含有Na2CO3;(2)含有Na2CO3和 NaHCO3【查阅资料】
| NaHCO3 | Na2CO3 | |
| 加入稀盐酸 | 现象I | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(2)现象Ⅱ对应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【实验探究】为了确定纯碱样品的成分,毕倭寇同学设计如下实验方案,请你一起完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
| A取少量样品溶于水,加入过量的CaCl2溶液 | ①有白色沉淀产生 | 该反应的方程式:②Na2CO3+CaCl2═CaCO3↓+2NaCl |
| B将上述反应后的混合液过滤,取滤液③滴加稀盐酸 | ④有气泡冒出 | 证明猜想②成立 |

【实验反思】实验步骤A中,氯化钙溶液过量的目的是将碳酸钠全部除去.
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,毕倭寇同学设了图1装置,通过称量B装置中质量变化来确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.
(2)毕倭寇同学在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①查装置气密性,将Wg干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.