题目内容
1.我校初三一班的部分同学准备用氢氧化钙溶液和稀盐酸进行了如下两个探究.Ⅰ探究反应是否发生.
(1)按照图1的方案完成实验:
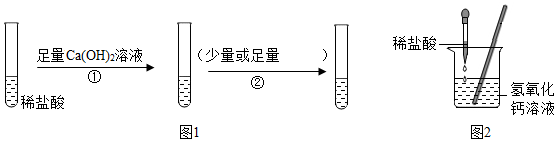
其中②处不可以选择的试剂是B(填序号,下同),若①②颠倒顺序,仍能证明盐酸与氢氧化钠发生了反应,这种试剂是C;
A.铁粉 B.硝酸银溶液 C.石蕊试液 D.碳酸钠溶液
(2)写出该反应化学方程式:Ca(OH)2+2HCl═CaCl2+2H2O;
Ⅱ探究反应后溶液中溶质的成分.
【提出问题】,按照图2进行实验后,烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2
猜想二:可能只有CaCl2
猜想三:CaCl2和HCl
【查阅资料】氯化钙溶液呈中性
【进行实验】
| 实验步骤 | 实验现象 | 解释和结论 |
| 取少量烧杯内溶液于试管中,滴入几滴酚酞试液(填试剂名称) | 溶液不变红 | 猜想一不正确 |
| 取少量烧杯内溶液于另一支试管中,滴加碳酸钠溶液至过量 | 开始有气泡产生,一段时间后产生沉淀 | 猜想二不正确 猜想三正确 |
分析 (1)根据氢离子的验证方法分析.
(2)根据氢氧化钙和盐酸反应生成了氯化钙和水写出反应的方程式;
猜想:三根据反应的程度进行猜想:恰好反应、一种物质完全反应,另一种物质有剩余;
根据酚酞遇碱变红、碳酸钠的化学性质分析.
解答 解:(1)盐酸和氢氧化钙发生反应的方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;由于加入足量的氢氧化钙溶液,所以如果发生反应,溶液显碱性,可以用铁粉、石蕊试液、碳酸钠溶液验证溶液中是否有氢离子;但是AgNO3溶液与CaCl2同样会生成沉淀,无法验证HCl是否参加了反应,若①②颠倒顺序,加入石蕊试液后溶液会从红色变为紫色再变为蓝色,仍能证明盐酸与氢氧化钙发生了反应,故填:B;C.
(2)氢氧化钙和盐酸反应生成了氯化钙和水,因此反应的方程式为:Ca(OH)2+2HCl═CaCl2+2H2O,故填:Ca(OH)2+2HCl═CaCl2+2H2O;
猜想:反应可能是恰好反应,只有氯化钙、也可能是一种物质完全反应,另一种物质有剩余,若氢氧化钙过量,则含有氢氧化钙和氯化钙;若盐酸过量,则含有盐酸和氯化钙,故填:CaCl2和HCl;
【进行实验】猜想一不正确,因为酚酞遇碱会变红色,故说明无色酚酞溶液不变色;
猜想三正确,说明含有盐酸,碳酸钠能与盐酸反应生成二氧化碳气体,故加入碳酸钠,开始观察到有气泡产生,一段时间后才产生沉淀;故填:酚酞试液;开始有气泡产生,一段时间后产生沉淀.
点评 本题考查了酸碱中和反应以及实验设计的能力.设计实验时,可以从反应后的产物和其有关的性质着手.

练习册系列答案
相关题目
12.取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁,各取少许花汁,用稀盐酸和稀碱进行检验,结果如表所示:
则下列说法不正确的是( )
| 花的种类 | 花汁在酒精中的颜色 | 花汁在酸溶液中的颜色 | 花汁在碱溶液中的颜色 |
| 大红花 | 粉红色 | 橙色 | 绿色 |
| 万寿菊 | 黄色 | 黄色 | 黄色 |
| 雏菊 | 无色 | 无色 | 黄色 |
| A. | 研磨花瓣时加入酒精是为了溶解其中的色素 | |
| B. | 万寿菊不能用作酸碱指示剂 | |
| C. | 遇到pH=10的溶液,大红花汁会变成粉红色 | |
| D. | 可用雏菊花汁来区别稀盐酸和氢氧化钠溶液 |
10.下面材料中的横线上应该填写的内容是( )
磁铁矿的主要成分是( ),因为它具有很强的磁性,所以中国古籍中又称其为磁石.其含铁量为72.45%,是最重要的铁矿石.该矿石中所含的有害元素很少,可直接用于平炉炼钢.
磁铁矿的主要成分是( ),因为它具有很强的磁性,所以中国古籍中又称其为磁石.其含铁量为72.45%,是最重要的铁矿石.该矿石中所含的有害元素很少,可直接用于平炉炼钢.
| A. | Fe3O4 | B. | Fe2O3 | C. | FeCO3 | D. | CuFeS2 |
17.下列实验现象的描述中,不正确的是( )
| A. | 硫在空气中燃烧,产生刺激性气味的气体 | |
| B. | 在点燃的蜡烛火焰上压一块白瓷板,白瓷板上有黑色烟点 | |
| C. | 氢气在空气中燃烧发出淡蓝色火焰 | |
| D. | 木炭在氧气中燃烧,发出白光,生成二氧化碳 |
6.生石灰是一种传统的建筑材料,俗称“石灰”.工业上通过在石灰窑中煅烧石灰石制得“石灰”,其反应原理是:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.兴趣小组的同学对某地刚出窑的“石灰”的成分进行探究.
【提出问题】刚出窑的“石灰”有哪些成分?
【猜想】Ⅰ.只有氧化钙Ⅱ.只有碳酸钙Ⅲ.既有氧化钙也有碳酸钙
【实验探究】
(1)甲同学从样品中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物.甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅱ成立.乙同学认为上述实验不足以证明猜想Ⅱ成立,其理由是氧化钙和水反应生成氢氧化钙,氢氧化钙微溶于水.
(2)乙同学从样品中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生.乙同学据此认为试管中的固体只有氧化钙,即猜想I成立.丙同学认为乙的实验不足以证明猜想I成立,理由是稀盐酸太少,少量的稀盐酸只能和氧化钙或氢氧化钙反应.
(3)丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他用水、酚酞试液和稀盐酸证明了猜想Ⅲ成立,请完成他的实验报告.
【思考】使用“石灰”的建筑工地上常有一个大的石灰池,使用“石灰”时,先将生石灰倒入池内水中,一段时间后,再取用其中的石灰浆使用.长期使用的石灰池内壁会逐渐增厚,其主要原因是氢氧化钙和空气中的二氧化碳反应生成了碳酸钙和水.
【提出问题】刚出窑的“石灰”有哪些成分?
【猜想】Ⅰ.只有氧化钙Ⅱ.只有碳酸钙Ⅲ.既有氧化钙也有碳酸钙
【实验探究】
(1)甲同学从样品中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物.甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅱ成立.乙同学认为上述实验不足以证明猜想Ⅱ成立,其理由是氧化钙和水反应生成氢氧化钙,氢氧化钙微溶于水.
(2)乙同学从样品中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生.乙同学据此认为试管中的固体只有氧化钙,即猜想I成立.丙同学认为乙的实验不足以证明猜想I成立,理由是稀盐酸太少,少量的稀盐酸只能和氧化钙或氢氧化钙反应.
(3)丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他用水、酚酞试液和稀盐酸证明了猜想Ⅲ成立,请完成他的实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| ①从样品中取一定量的固体于试管中,加入足量稀盐酸 ②从样品中取一定量的固体于试管中,加入一定量的水,滴加无色酚酞试液 | 产生气泡; 酚酞试液变红色 | 猜想Ⅲ成立 |
13. “双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体.某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,涉及实验进行探究.
“双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体.某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,涉及实验进行探究.
【提出问题】:久置固体的成分是什么?
【收集资料】:
1、查阅资料:铁与氯化铁溶液在常温下生成氯化亚铁:Fe+2FeCl3═3FeCl2
2、打开固体包装观察:部分粉末呈黑色、部分粉末呈白色、另有少数红棕色的块状固体.
【作出猜想】:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
【实验探究】:如表是甲组同学涉及并记录的实验报告,请你补充完整.
【实验质疑】:乙组同学认为甲组同学在实验中得出“一定不含有Fe2O3”的结论是错误的,理由是氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色;你认为甲组同学哪一步操作得出的结论也不合理操作二,理由是(用化学方程式表示)CaO+H2O=Ca(OH)2.
【继续探究】:为验证固体中是否含有Fe2O3,乙组同学用磁铁先分离出铁粉,向残留固体中加入足量稀盐酸,若溶液呈棕黄色,证明固体中含有Fe2O3.写出溶液呈棕黄色的化学反应方程式Fe2O3+6HCl=2FeCl3+3H2O.
 “双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体.某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,涉及实验进行探究.
“双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体.某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示.同学们对这包久置的“504双吸剂”的固体样品很好奇,涉及实验进行探究.【提出问题】:久置固体的成分是什么?
【收集资料】:
1、查阅资料:铁与氯化铁溶液在常温下生成氯化亚铁:Fe+2FeCl3═3FeCl2
2、打开固体包装观察:部分粉末呈黑色、部分粉末呈白色、另有少数红棕色的块状固体.
【作出猜想】:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
【实验探究】:如表是甲组同学涉及并记录的实验报告,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| 一、取少量固体加入足量蒸馏水,搅拌溶解 | 固体部分溶解,并放出大量热 | 固体中一定含有CaO. |
| 二、过滤,取滤液滴加无色酚酞试液 | 溶液变红色 | 固体中一定含有氢氧化钙 |
| 三、取滤渣加入足量稀盐酸 | 固体逐渐消失,产生大量无色气体,得到浅绿色溶液 | 固体中一定含有Fe,一定不含有Fe2O3 |
| 四、将操作三中产生的气体通入到澄清石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有CaCO3. |
【继续探究】:为验证固体中是否含有Fe2O3,乙组同学用磁铁先分离出铁粉,向残留固体中加入足量稀盐酸,若溶液呈棕黄色,证明固体中含有Fe2O3.写出溶液呈棕黄色的化学反应方程式Fe2O3+6HCl=2FeCl3+3H2O.
11. 学习碳单质的性质时,某校实验小组的同学为探究碳的化学性质,按如下实验装置对木炭与氧化铜的反应进行实验探究.请你完成下列问题.
学习碳单质的性质时,某校实验小组的同学为探究碳的化学性质,按如下实验装置对木炭与氧化铜的反应进行实验探究.请你完成下列问题.
(1)实验目的:探究木炭是否具有还原性.
(2)实验用品:仪器:酒精灯,试管,铁架台.药品:木炭,氧化铜,澄清石灰水.
(3)实验中酒精灯加网罩的作用是提高温度.
(4)
(5)结论:木炭具有还原性.
(6)碳和氧化铜反应生成铜和二氧化碳.现有碳和氧化铜的混合物20g,高温加热混合物一段时间后,产生4.4g二氧化碳.求混合物中氧化铜的质量分数.
 学习碳单质的性质时,某校实验小组的同学为探究碳的化学性质,按如下实验装置对木炭与氧化铜的反应进行实验探究.请你完成下列问题.
学习碳单质的性质时,某校实验小组的同学为探究碳的化学性质,按如下实验装置对木炭与氧化铜的反应进行实验探究.请你完成下列问题.(1)实验目的:探究木炭是否具有还原性.
(2)实验用品:仪器:酒精灯,试管,铁架台.药品:木炭,氧化铜,澄清石灰水.
(3)实验中酒精灯加网罩的作用是提高温度.
(4)
| 实验现象 | 原因分析 |
| ① | |
| ② |
(6)碳和氧化铜反应生成铜和二氧化碳.现有碳和氧化铜的混合物20g,高温加热混合物一段时间后,产生4.4g二氧化碳.求混合物中氧化铜的质量分数.

 已知A、B、C、D、E是初中化学中五种常见的纯净物,五种物质中只有A为黑色其余都为无色,A、E为单质其余都为化合物,B、C所含元素相同,相对分子质量:C>B>D=18;由于条件不同A和E反应可生成B也可生成C.五种物质在一定条件下的转化关系如图所示(“-”表示相连物质间能反应,“→”表示物质间可转化,部分反应物和生成物没有列出).试推断并回答相关问题:
已知A、B、C、D、E是初中化学中五种常见的纯净物,五种物质中只有A为黑色其余都为无色,A、E为单质其余都为化合物,B、C所含元素相同,相对分子质量:C>B>D=18;由于条件不同A和E反应可生成B也可生成C.五种物质在一定条件下的转化关系如图所示(“-”表示相连物质间能反应,“→”表示物质间可转化,部分反应物和生成物没有列出).试推断并回答相关问题: