题目内容
18.根据氯化钠和硝酸钾的溶解度表,回答下列问题:| 名称 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ |
| 氯化钠 | 35.8g | 36.0g | 36.3g | 36.6g | 37.0g | 37.3g | 37.8g |
| 硝酸钾 | 20.9g | 31.6g | 45.8g | 63.9g | 85.5g | 110g | 138g |
(2)在60℃时,向50g水中加入60g 硝酸钾,充分搅拌后所得溶液质量为92.75g
(3)20℃时,200g溶质的质量分数为20%的氯化钠溶液加热蒸发掉60g水后降温至20℃,试求此时从溶液中析出的氯化钠的质量4g.
分析 (1)根据在20~40℃时,氯化钠和硝酸钾的溶解度分别为36.0g-36.6g、31.6-63.9,进行分析解答.
(2)根据50℃时,硝酸钾的溶解度为85.5g,进行分析解答.
(3)根据20℃时,氯化钠的溶解度为36.0g,进行分析解答.
解答 解:(1)由表中的数据可知,在20~40℃时,氯化钠和硝酸钾的溶解度分别为36.0g-36.6g、31.6g-63.9g,故20~40℃温度范围内氯化钠、硝酸钾两种物质的溶解度相等.
(2)50℃时,硝酸钾的溶解度为85.5g,100克水最多溶解85.5克硝酸钾,则50g水中最多能溶解42.75g,则充分搅拌后所得溶液质量为50g+42.75g=92.75g.
(3)20℃时,200g溶质的质量分数为20%的氯化钠溶液加热蒸发掉60g水后降温至20℃,还是该温度下的饱和溶液,设析出氯化钠晶体的质量为x,
则$\frac{36g}{100g+36g}$=$\frac{200g×20%-x}{200g-60g-x}$ x=4g.
故答案为:(1)20~40℃;(2)92.75g;(3)4g.
点评 本题难度不大,溶质质量分数的有关计算、溶解度的含义等并能灵活运用是正确解答本题的关键.

练习册系列答案
相关题目
8.某化学兴趣小组的同学要探究铝、铁、铜三种金属的活动性顺序,请你参与探究并填写空格.
【实验探究】同学们将粗细相同的、打磨过的铝丝和铁丝分别插入硫酸亚铁溶液、硫酸铜溶液中:
写出铝与硫酸铜溶液反应的化学方程式2Al+3CuSO4=Al2(SO4)3+3Cu.
【交流讨论】
(1)同学们经讨论后认为上述方案可以优化,丙(选填“甲”、“乙”或“丙”)试管的实验时多余的.
(2)洁洁认为,只用一支盛有少量稀硫酸的试管,合理安排金属丝的插入顺序(能与稀硫酸反应的要一次将稀硫酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序.他设计了两种插入顺序,请你补全顺序二:
顺序一:Cu Fe Al;顺序二:Fe Cu Al.
洁洁按顺序一做实验时,发现铁丝放入稀硫酸中片刻后无气泡产生,几分钟后才有少量气泡产生,你认为可能的原因是Fe2O3+3H2SO4═Fe2(SO4)3+3H2O(用化学方程式表示).
【拓展迁移】为了回收金属,同学们将甲、乙、丙三支试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物和滤液.向不溶物中加稀硫酸,若无气泡产生,则不溶物中一定含有铜.
若有气泡产生则不溶物中一定含有铜、铁,可能含有铝.
【实验探究】同学们将粗细相同的、打磨过的铝丝和铁丝分别插入硫酸亚铁溶液、硫酸铜溶液中:
| 操作 |  甲 | 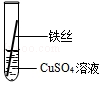 乙 乙 | 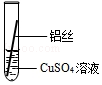 丙 | 根据现象得出金属活动性顺序 |
| 现象 | 铝丝表面附着银白色固体 | 铁丝表面附着红色固体 | 铝丝表面附着红色固体 | 铝>铁>铜 |
【交流讨论】
(1)同学们经讨论后认为上述方案可以优化,丙(选填“甲”、“乙”或“丙”)试管的实验时多余的.
(2)洁洁认为,只用一支盛有少量稀硫酸的试管,合理安排金属丝的插入顺序(能与稀硫酸反应的要一次将稀硫酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序.他设计了两种插入顺序,请你补全顺序二:
顺序一:Cu Fe Al;顺序二:Fe Cu Al.
洁洁按顺序一做实验时,发现铁丝放入稀硫酸中片刻后无气泡产生,几分钟后才有少量气泡产生,你认为可能的原因是Fe2O3+3H2SO4═Fe2(SO4)3+3H2O(用化学方程式表示).
【拓展迁移】为了回收金属,同学们将甲、乙、丙三支试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物和滤液.向不溶物中加稀硫酸,若无气泡产生,则不溶物中一定含有铜.
若有气泡产生则不溶物中一定含有铜、铁,可能含有铝.
9.下列化学用语中,既可用来表示元素、一个原子,又可用来表示物质的是( )
| A. | O2 | B. | H | C. | H2O | D. | He |
6.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取20g样品放入烧杯中,再取120g稀硫酸分六次加入烧杯中,均充分反应,实验数据如下:
(1)m值为14.
(2)黄铜样品中锌的质量分数为多少?
(3)所用稀硫酸的质量分数为多少?
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
| 加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量(g) | 18.7 | 17.4 | 16.1 | 14.8 | m | 14 |
(2)黄铜样品中锌的质量分数为多少?
(3)所用稀硫酸的质量分数为多少?
13.某班甲、乙两组同学分别做常见酸和碱与指示剂反应的实验,使用的试剂有稀盐酸、稀硫酸、氢氧化钠溶液和酚酞试液.实验后废液分别集中到各组的一个废液缸中.研究小组对两个组的废液进行检测,结果如下表.下列说法错误的是(不考虑酚酞和水)( )
| 废液来源 | 甲组 | 乙组 |
| 检测方法与结果 | 观察废液呈无色 | 观察废液呈红色 |
| A. | 甲组废液中可能含有稀盐酸和稀硫酸 | |
| B. | 乙组废液中一定含有氢氧化钠 | |
| C. | 直接将甲组的废液排入铸铁管下水道,可能腐蚀铸铁水管 | |
| D. | 乙组呈红色是因为氢氧化钠溶液遇到酚酞试液会变红色 |
10.下列属于酸和碱的反应的是( )
| A. | 2NaOH+SO2=Na2SO3+H2O | B. | NaCl+AgNO3=NaNO3+AgCl↓ | ||
| C. | Ba(OH)2+H2SO4=BaSO4↓+2H2O | D. | CaCO3+2HCl=CaCl2+H2O+CO2↑ |
