题目内容
将氯酸钾和二氧化锰的固体混合物50克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为30.8克.试问:
(1)生成氧气的质量是多少克?
(2)原混合物中氯酸钾和二氧化锰分别为多少克?
解:(1)根据质量守恒定律,待反应至不再有气体生成后,制取氧气的质量为:50g-30.8g=19.2g;
(2)设原混合物中氯酸钾的质量为 x
2KClO3 2KCl+3O2↑
2KCl+3O2↑
245 96
x 19.2g
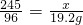
解答 x=49 g
混合物中二氧化锰的质量为:50g-49g=1 g
故答案为;(1)19.2g;
(2)KClO3:49g; MnO2:1g;
答:(1)生成氧气的质量是19.2克;
(2)原混合物中氯酸钾和二氧化锰分别为49g 和 1g.
分析:加热氯酸钾和二氧化锰的混合物,氯酸钾受热分解生成氯化钾和氧气,二氧化锰在变化过程中为催化剂,反应前后质量和化学性质都不变;
(1)根据质量守恒定律,由反应前后固体物质的质量差,可求得放出气体氧气的质量;
(2)根据反应的化学方程式,利用生成氧气的质量可计算混合物中氯酸钾的质量和二氧化锰的质量.
点评:解答此类题的方法是:首先利用质量守恒定律,根据反应前后固体物质质量差求得反应生成气体的质量;然后,利用化学方程式由气体质量计算其他物质的质量.
(2)设原混合物中氯酸钾的质量为 x
2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 96
x 19.2g
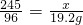
解答 x=49 g
混合物中二氧化锰的质量为:50g-49g=1 g
故答案为;(1)19.2g;
(2)KClO3:49g; MnO2:1g;
答:(1)生成氧气的质量是19.2克;
(2)原混合物中氯酸钾和二氧化锰分别为49g 和 1g.
分析:加热氯酸钾和二氧化锰的混合物,氯酸钾受热分解生成氯化钾和氧气,二氧化锰在变化过程中为催化剂,反应前后质量和化学性质都不变;
(1)根据质量守恒定律,由反应前后固体物质的质量差,可求得放出气体氧气的质量;
(2)根据反应的化学方程式,利用生成氧气的质量可计算混合物中氯酸钾的质量和二氧化锰的质量.
点评:解答此类题的方法是:首先利用质量守恒定律,根据反应前后固体物质质量差求得反应生成气体的质量;然后,利用化学方程式由气体质量计算其他物质的质量.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目

