题目内容
6.一包白色固体粉末,可能由氯化钠、硫酸铜、硫酸钠、氯化钡、碳酸钙中的一种或几种组成,为证明其成分,.做如下实验(如图所示):
(1)操作①是过滤.
(2)该白色粉末中一定没有CuSO4、CaCO3(填化学式,下同)可能含有NaCl.
(3)写出生成白色沉淀A的化学方程式BaCl2+Na2SO4=BaSO4↓+2NaCl.
(4)无色溶液B中一定含有的溶质是NaCl(填写化学式).
分析 根据硫酸铜在溶液中显蓝色,碳酸钙难溶于水,钡离子和硫酸根离子会生成硫酸钡沉淀,碳酸钙和盐酸反应会生成二氧化碳气体等知识进行分析.
解答 解:硫酸铜在溶液中显蓝色,碳酸钙难溶于水,钡离子和硫酸根离子会生成硫酸钡沉淀,碳酸钙和盐酸反应会生成二氧化碳气体.
将少量白色粉末放入足量的水中,搅拌、静置、过滤,得到白色固体和无色溶液,硫酸铜在溶液中显蓝色,所以粉末中一定不含硫酸铜,白色沉淀可能是碳酸钙,也可能是氯化钡和硫酸钠产生的硫酸钡沉淀,向所得固体中加入稀盐酸,白色固体不溶解,所以粉末中一定不含有碳酸钙,一定含有氯化钡、硫酸钠,题中的现象不能确定粉末中是否含有氯化钠,综合分析,粉末一定含有硫酸钠和氯化钡,一定不含有硫酸铜、碳酸钙,可能含有氯化钠,因此:
(1)操作①是将固体和液体的分离,因此是过滤;故填:过滤;
(2)粉末一定含有硫酸钠和氯化钡,一定不含有硫酸铜、碳酸钙,可能含有氯化钠;故填:CuSO4、CaCO3;NaCl;
(3)氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,故反应的化学方程式为:BaCl2+Na2SO4=BaSO4↓+2NaCl;
(4)氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,因此滤液B中含有氯化钠;故填:NaCl.
点评 本题为框图式推断题,在解此类题时,首先分析题中所给物质的性质,然后依据题中的现象确定各种物质的存在性,最后确定混合物的成分.

练习册系列答案
相关题目
16.下列物质加入水中充分搅拌后形成溶液的是( )
| A. | 面粉 | B. | 氯化钠 | C. | 汽油 | D. | 泥沙 |
17.下列变化中,属于化学变化的是( )
| A. | 酒精挥发 | B. | 轮胎在烈日下爆裂 | ||
| C. | 菜刀生锈 | D. | 瓷碗破碎 |
1.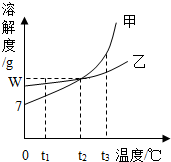 甲、乙两物质的溶解度曲线如图所示,下列叙述错误的是( )
甲、乙两物质的溶解度曲线如图所示,下列叙述错误的是( )
 甲、乙两物质的溶解度曲线如图所示,下列叙述错误的是( )
甲、乙两物质的溶解度曲线如图所示,下列叙述错误的是( )| A. | t1℃时,甲的溶解度小于乙的溶解度 | |
| B. | t1℃时,加入甲物质,可使不饱和的甲溶液变成饱和溶液 | |
| C. | 将甲、乙饱和溶液的温度从t3℃降到t1℃时,乙析出晶体比甲多 | |
| D. | t2℃时,甲或乙两种物质的饱和溶液中溶质与溶剂的质量比是W:100 |
15.甲、乙两种固体的溶解度曲线如图所示.下列说法中,不正确的是( )


| A. | 20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数 | |
| B. | 40℃时,分别在100 g水中加入40g甲、乙,所得溶液溶质的质量分数相等 | |
| C. | 甲、乙两种物质都属于易溶物质 | |
| D. | 20℃时,分别在100 g水中加入40g甲、乙,加热到40℃时,乙溶液为饱和溶液 |

