题目内容
17.现有以下几种常见的物质:A.干冰 B. 氢氧化钠 C.金刚石 D.小苏打E.氢氧化钙 F.甲烷,请选择合适物质的序号填空
①天然存在最硬的物质C; ②海底“可燃冰”的主要成分是F;
③用于治疗胃酸过多物质D; ④用于改良酸性土壤的物质E.
分析 ①根据天然存在最硬的物质是金刚石进行解答;
②根据海底“可燃冰”的主要成分是甲烷解答;
③根据小苏打溶于水显碱性,且能和盐酸反应进行解答;
④根据氢氧化钙呈碱性,可用于改良酸性土壤解答.
解答 解:
①天然存在最硬的物质是金刚石.
②海底“可燃冰”的主要成分是甲烷;
③小苏打溶于水显碱性,且能和盐酸反应,用于治疗胃酸过多;
④氢氧化钙呈碱性,可用于改良酸性土壤.
答案:①C; ②F; ③D;④E.
点评 本题难度不大,熟练掌握常见物质的性质、用途、组成是正确解答此类题的关键所在.

练习册系列答案
相关题目
8.乐乐想在妈妈生日那天为妈妈做一顿午餐,食谱为:米饭、鸡肉、蛋汤、大虾、鱼.为使营养均衡,你觉得最好还要补充( )
| A. | 青菜 | B. | 豆浆 | C. | 牛奶 | D. | 鸭肉 |
5.以下实验现象描述错误的是( )
| A. | 木炭在氧气中燃烧,发出白光,生成无色气体 | |
| B. | 向Na2CO3溶液中滴加澄清的石灰水,有白色沉淀产生 | |
| C. | CO还原Fe2O3的实验后,玻璃管中的粉末由红棕色变成黑色 | |
| D. | 用石蕊溶液染成的干燥的纸花放入CO2集气瓶中,纸花变红色 |
2.下列各组物质,其化学性质不相似的是( )
| A. | 冰、干冰 | B. | 锌、铁 | ||
| C. | 氢氧化钙、氢氧化钠 | D. | 稀盐酸、稀硫酸 |
9.下列物质的俗称与化学式一致的是( )
| A. | 水银--Ag | B. | 熟石灰--CaO | C. | 苏打--Na2CO3 | D. | 纯碱--NaOH |
6. 小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.
小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.
【提出问题】金属与酸反应的快慢受哪些因素影响呢?
【猜想与假设】
A.可能与酸的浓度有关;
B.可能与金属的种类有关;
C.可能与金属的形状有关.
【设计并实验】小明和小芳进行如下实验.
(1)实验时需将镁片和铁片进行打磨,其目的是除去金属表面的氧化物.
(2)写出铁与稀盐酸反应的化学方程式:Fe+2HCl=FeCl2+H2↑.
【收集证据】
(3)要比较不同金属的种类对反应快慢的影响,应选择的实验编号是②③.
【得出结论】
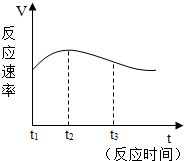
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应.实验测得该反应中产生气体的速率(V)与时间(t)的关系如图所示,你认为在t2~t3时间段内反应速率逐渐减慢的主要原因由于镁与盐酸反应消耗了盐酸,盐酸的浓度变小,因此反应速率逐渐减慢.
【实验反思】本实验采用的定量比较气体产生速率的方法是收集相同体积的气体需要的时间.
 小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.
小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.【提出问题】金属与酸反应的快慢受哪些因素影响呢?
【猜想与假设】
A.可能与酸的浓度有关;
B.可能与金属的种类有关;
C.可能与金属的形状有关.
【设计并实验】小明和小芳进行如下实验.
| 实验编号 | 盐酸的浓度 (均取20mL) | 金属 (均取2g) | 金属的形状 | 收集50mL氢气所需要时间/s |
| ① | 10% | 镁 | 粉状 | 60 |
| ② | 10% | 铁 | 片状 | 120 |
| ③ | 10% | 镁 | 片状 | 102 |
| ④ | 20% | 铁 | 片状 | 110 |
(2)写出铁与稀盐酸反应的化学方程式:Fe+2HCl=FeCl2+H2↑.
【收集证据】
(3)要比较不同金属的种类对反应快慢的影响,应选择的实验编号是②③.
【得出结论】
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应.实验测得该反应中产生气体的速率(V)与时间(t)的关系如图所示,你认为在t2~t3时间段内反应速率逐渐减慢的主要原因由于镁与盐酸反应消耗了盐酸,盐酸的浓度变小,因此反应速率逐渐减慢.
【实验反思】本实验采用的定量比较气体产生速率的方法是收集相同体积的气体需要的时间.