题目内容
14.将200克高锰酸钾放入大试管中,加热一段时间后,称量剩余固体的质量为184克,求:①生成氧气的质量 ②剩余高锰酸钾的质量.分析 高锰酸钾受热分解后生成锰酸钾、二氧化锰和氧气,由于氧气逸出,所以反应后固体质量会减少;根据质量守恒定律可知,固体质量的减少量即为生成氧气的质量,然后根据反应方程式由氧气的质量求出参加反应的高锰酸钾及剩余的高锰酸钾和二氧化锰的质量.
解答 解:设参加反应的高锰酸钾的质量为x,则
生成氧气的质量为200g-184g═16g
2KMnO4═K2MnO4+MnO2+O2↑
316 32
X 16g
$\frac{316}{x}=\frac{32}{16g}$
X=158g
剩余高锰酸钾的质量为:200g-158g=42g
答:生成氧气的质量为16g;剩余高锰酸钾的质量为42g.
点评 此题考查的根据关化学方程式的计算,通过认真分析题干,直接得到氧气的质量,然后再求其他反应物的质量.此题计算量较大,计算一定要细心准确.

练习册系列答案
相关题目
2.下列关于水的说法正确的是( )
| A. | 水是由2个氢原子和一个氧原子构成 | |
| B. | 矿泉水是纯天然饮品,不含任何化学物质 | |
| C. | 水在化学反应中只充当溶剂不参加反应 | |
| D. | 日常生活中的水大多是混合物 |
6.同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究.
【推理假设】上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.
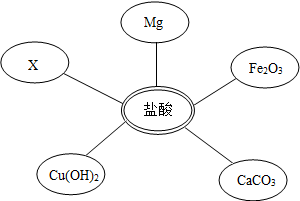
②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生(或无现象或无变化),确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸(或pH计)测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
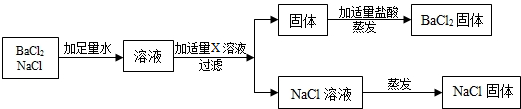
(4)拓展运用:按如图方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是Na2CO3.相关反应方程式如下Na2CO3+BaCl2=BaCO3↓+2NaCl;BaCO3+2HCl=BaCl2+H2O+CO2↑.
【推理假设】上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.

②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生(或无现象或无变化),确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸(或pH计)测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
| 方案 | 加入试剂 | 提纯的方法 | 方案评价 |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | (选填可行或不可行) |
| 二 | 稍过量的盐酸(或稀HCl或HCl) | 蒸发结晶 | 可行 |

 如图所示,各连线两端物质相互都能发生反应,试推断X可能是C
如图所示,各连线两端物质相互都能发生反应,试推断X可能是C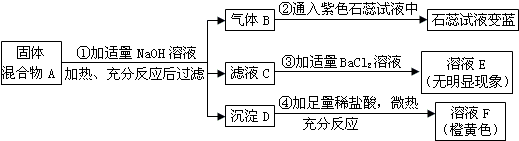
 合金是重要的金属材料.
合金是重要的金属材料.