题目内容
3.小红为大家做了一个“燃纸成铁”的趣味实验.将一张滤纸(组成元素为C、H、O)用FeCl3浓溶液润湿,在酒精灯上烘干后点燃,滤纸变黑、红热,最终生成黑褐色物质.小红告诉大家:黑褐色物质中含有铁单质.【提出问题】黑褐色物质中真的含有铁单质吗?
【探究过程】
(1)小红先从反应物分析,因为反应物中含有铁元素所以反应后可能生成铁单质.
(2)为获得实验证据,小红做了实验1.
实验1:将黑褐色物质放入稀盐酸中,发现有连续微小气泡产生.若黑褐色物质中含有铁单质,则反应的化学方程式为Fe+2HCl═FeCl2+H2↑.
(3)小明提出疑问:由反应物的组成分析,能与稀盐酸反应产生气泡的物质不一定是铁单质,还可能是碳酸亚铁或者碳酸铁.小红通过查阅资料得知,在高温条件下不可能生成此类物质.
(4)小明仍有疑问:实验1中产生的气泡也可能是滤纸碳化后吸附的空气.
为此,小红又做了实验1的对比实验:将黑褐色物质放入蒸馏水中观察到有微小气泡产生但很快停止.证明实验1中的连续气泡确实是由铁单质与稀盐酸反应产生的.
(5)为进一步证明黑褐色物质中有铁单质,小红选择了某盐溶液又做了实验2.
实验2:将黑褐色物质放入硫酸铜溶液中,观察到黑褐色物质表面有红色固体产生也能证明黑褐色物质中有铁单质.
【得出结论】通过以上探究,证明黑褐色物质中确实含有铁单质.
分析 【探究过程】(1)根据质量守恒定律来进行解答;
(2)根据铁和盐酸反应的化学方程式进行解答;
(3)根据盐酸的性质可以知道,碳酸盐也可以和盐酸反应生成气体,可以据此解答;
(4)若滤纸碳化后吸附了空气,则在水中也能产生气泡,所有可以将该黑褐色固体加入蒸馏水中,观察气泡的持续性,即可完成判断;
(5)实验2:根据铁单质和硫酸铜溶液的反应生成红色的铜,现象较明显,可以据此来进行解答;
解答 解:【探究过程】(1)根据质量守恒定律可以知道,反应前后元素的种类不变,由于反应物中含有铁元素,所以可能生成铁单质;
(2)铁和盐酸反应生成了氢气和氯化亚铁,其反应的化学方程式为:Fe+2HCl═FeCl2+H2↑;
(3)由于反应物中含碳元素和氧元素,而碳酸盐也能和盐酸反应生成气体,故该固体中可能含有碳酸亚铁或者碳酸铁;
(4)若滤纸碳化后吸附了空气,则在水中也能产生气泡,所有可以将该黑褐色固体加入蒸馏水中进行验证;
(5)实验2:铁的活动性比铜强,可以和硫酸铜溶液的反应生成铜,而铜为红色固体,所以可以将该黑褐色固体加入硫酸铜溶液中,若观察到黑褐色物质表面有红色固体产生,则说明含有铁;
故答案为:【探究过程】(1)反应物中含有铁元素;
(2)Fe+2HCl═FeCl2+H2↑;
(3)碳酸亚铁或者碳酸铁;
(4)将黑褐色物质放入蒸馏水中;
(5)硫酸铜;黑褐色物质表面有红色固体产生;
点评 解答这类题目时,首先,赏析问题情景,找到实验探究的反应原理;再根据实验的反应原理,利用所取的样品进行实验探究,分析推断出该物质的组成成分即可;注意物质的性质的应用.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
14.下列符号中,只有微观意义的是( )
| A. | Fe | B. | H | C. | 2N | D. | O |
12.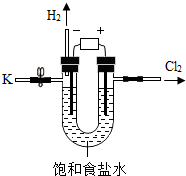 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
老师提示:I.电解饱和食盐水的化学方程式:
2NaCl+2H2O═2NaOH+H2↑+Cl2↑
II.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
探究活动二:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
(2)写出氢氧化钠与稀盐酸反应的化学方程式:NaOH+HCl═NaCl+H2O.
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应从选用稀盐酸的体积为 mL.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液混合发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl
乙组同学按下图所示的实验步骤进行实验:

(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)步骤③过滤出的沉淀物是.步骤④中证明沉淀洗涤干净的方法是取最后一次洗涤的液体滴加硝酸银溶液,无白色沉淀.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.老师提示:I.电解饱和食盐水的化学方程式:
2NaCl+2H2O═2NaOH+H2↑+Cl2↑
II.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 待测液呈碱性,表明含有氢氧化钠 |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应从选用稀盐酸的体积为 mL.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液混合发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl
乙组同学按下图所示的实验步骤进行实验:

(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)步骤③过滤出的沉淀物是.步骤④中证明沉淀洗涤干净的方法是取最后一次洗涤的液体滴加硝酸银溶液,无白色沉淀.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).

 写离子符号S2-该元素的原子核外有三个电子层,它属于非金属元素(填“金属”、“非金属”),其化学性质比较活泼,在化学反应中易得到(填“得到”、“失去”)电子.
写离子符号S2-该元素的原子核外有三个电子层,它属于非金属元素(填“金属”、“非金属”),其化学性质比较活泼,在化学反应中易得到(填“得到”、“失去”)电子.

 某兴趣小组用下图所示的装置做有关二氧化碳气体的实验.某同学将收集满二氧化碳气体的试管倒插入盛有紫色石蕊试液的水槽中,并轻轻振荡试管.
某兴趣小组用下图所示的装置做有关二氧化碳气体的实验.某同学将收集满二氧化碳气体的试管倒插入盛有紫色石蕊试液的水槽中,并轻轻振荡试管.