题目内容
18.在如图所示的四个图象中,能正确反映出等质量的金属镁和铁在足量的稀盐酸中,产生的气体和时间的变化关系的是( )| A. |  | B. |  | C. |  | D. |  |
分析 根据镁的金属活动性比铁强,所以反应速率快,图象的斜率大,镁的相对原子质量小,所以等质量的镁、铁与稀盐酸反应时,生成的氢气质量多进行分析.
解答 解:镁的金属活动性比铁强,所以反应速率快,图象的斜率大,镁的相对原子质量小,所以等质量的镁、铁与稀盐酸反应时,生成的氢气质量多,故选:B.
点评 本题主要考查了金属活动性顺序的应用,难度不大,注意在平时加强训练即可完成.

练习册系列答案
相关题目
13.如图所示,用玻璃杯罩住两支燃烧的蜡烛,一段时间后,下列现象与结论正确的是( )

| A. | 低的蜡烛先灭,因为二氧化碳的密度比空气的密度大 | |
| B. | 高的蜡烛先灭,气体受热膨胀,二氧化碳会上升,聚在玻璃杯的上方 | |
| C. | 该实验说明人从着火的房间逃离时,必须呈站立姿势跑出 | |
| D. | 两只蜡烛同时熄灭,因为玻璃杯中充满了二氧化碳气体 |
 某黑色固体含有MnO2、Na2SO4、KCl、C(少量)等物质.化学小组欲通过以下流程,分离并回收部分物质.回答相关问题;
某黑色固体含有MnO2、Na2SO4、KCl、C(少量)等物质.化学小组欲通过以下流程,分离并回收部分物质.回答相关问题; 中央电视台播放的大型纪录片《水问》,向人们说明了水是生命之源,万物之基,是人类最宝贵的自然资源,唤起人们关心水、爱护水、节约水的意识.
中央电视台播放的大型纪录片《水问》,向人们说明了水是生命之源,万物之基,是人类最宝贵的自然资源,唤起人们关心水、爱护水、节约水的意识.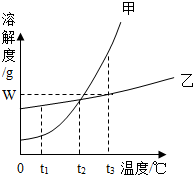 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.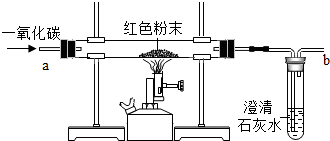 课堂上,老师给了同学们一包红色粉未,该粉末可能是铜粉和和氧化铁粉中的一种或两种.为确定该粉末的成分,同学们进行如下探究.请你参与其中并回答问题.
课堂上,老师给了同学们一包红色粉未,该粉末可能是铜粉和和氧化铁粉中的一种或两种.为确定该粉末的成分,同学们进行如下探究.请你参与其中并回答问题.