题目内容

对实验进行分析并回答:
(1)给玻璃管加热的仪器叫做酒精喷灯,要用其
(2)实验中玻璃管里氧化铁粉末的颜色变化是
(3)实验要在装置末端a处燃着一盏酒精灯,其作用是
(4)写出一氧化碳与氧化铁反应的化学方程式:
| ||
| ||
(2)根据反应物和生成物,分析实验中玻璃管里氧化铁粉末的颜色变化.根据二氧化碳能与氢氧化钙反应分析澄清石灰水的现象;
(3)根据一氧化碳是对大气有污染的气体分析;
(4)一氧化碳还原氧化铁的反应原理为:3CO+Fe2O3
| ||
(2)由于在高温下,一氧化碳将氧化铁还原为铁,同时生成了二氧化碳.所以,实验中玻璃管里氧化铁粉末的颜色变化是红色粉末变黑色;二氧化碳能与氢氧化钙反应生成了碳酸钙沉淀和水.所以,观察到澄清石灰水的现象是:石灰水变浑浊;
(3)为了防止一氧化碳对大气的污染,所以,实验时要在装置末端a处燃着一盏酒精灯除去反应剩余的CO;
(4)为了防止一氧化碳对大气的污染,所以,实验时要在装置末端a处燃着一盏酒精灯除去反应剩余的CO;
故答案为:(1)外焰;
(2)红色粉末变为黑色,澄清石灰水变浑浊;
(3)点燃尾气,为了防止一氧化碳对大气的污染;
(4)Fe2O3+3CO
| ||

(11分)铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是____
(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
|
金属单质 |
铜 |
铝 |
锌 |
铁 |
铅 |
|
导电性(以银的导电性为100作标准) |
99 |
61 |
27 |
17 |
7.9 |
|
密度/(g·cm-3) |
8.92 |
2.70 |
7.14 |
7.86 |
11.3 |
|
熔点/℃ |
1083 |
660 |
419 |
1535 |
328 |
|
硬度(以金刚石的硬度为10作标准) |
2.5~3 |
2~2.9 |
2.5 |
4~5 |
1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是
_________________________________________________________。
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
⑴金属的位置越靠前它的活动性就越强;
⑵位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
⑶位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为 ,由此我发现了一条新的判断依据 。
 (4)炼铁的原理是利用一氧化碳与氧
(4)炼铁的原理是利用一氧化碳与氧
化铁反应。在实验室里,可用右图
所示装置进行实验:实验中玻璃管内
的粉末由红色变为 色,该反
应的化学方程式为 ,通过实
验我可以得出的一氧化碳的相关
化学性质是 。
(5)工业上火法炼铜的一个主要反应是 Cu2S
+ O2  2Cu
+ SO2 Cu2S中铜元素的质量分数为_______________
(写出算式)。
2Cu
+ SO2 Cu2S中铜元素的质量分数为_______________
(写出算式)。
用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)

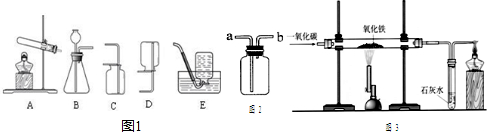
 氧化碳和氧化铁的反应。某化学兴趣小组利用下图装置进行实验探究,请按要求填空:
氧化碳和氧化铁的反应。某化学兴趣小组利用下图装置进行实验探究,请按要求填空:
 铁炼制而成的,
铁炼制而成的, 在炼钢的过程中用纯氧而不用空气的原因是___________。
在炼钢的过程中用纯氧而不用空气的原因是___________。