题目内容
20.氢氧化钠是一种重要的化工原料,具有广泛的应用.(1)氢氧化钠在水中解离出的离子是Na+、OH-(填离子符号).
(2)航天员穿的舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是③.(填序号)
①与二氧化碳反应
②与盐酸反应
③与氧化铁反应
④与氯化铜溶液反应
(3)将一定量的氢氧化钠固体溶于水制成40g溶液,向此溶液中加入足量硫酸铜溶液,完全反应后,得到沉淀4.9g.请计算:参加反应的氢氧化钠与硫酸铜的质量比是1:2;氢氧化钠溶液中溶质的质量分数是10%.
分析 (1)根据碱电离出金属离子与氢氧根离子的规律,判断氢氧化钠电离所得的离子;
(2)根据与氢氧化钠性质相似的氢氧化锂,利用碱的通用性判断氢氧化锂的性质;
(3)根据氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜沉淀反应的化学方程式,可得知反应中氢氧化钠与硫酸铜的质量比;由反应生成沉淀的质量计算出溶液中氢氧化钠的质量,利用溶液中溶质质量分数公式,计算出氢氧化钠溶液中溶质的质量分数.
解答 解:(1)根据氢氧化钠的电离方程式NaOH═Na++OH-,氢氧化钠在水中解离出的离子是Na+、OH-;
(2)碱能与二氧化碳发生反应,故①可能;碱可与盐酸发生中和反应,故②可能;碱不能与氧化铁等金属氧化物反应,故③不可能;碱可与可溶性盐反应,氢氧化锂与氯化铜可生成氢氧化铜沉淀,故④可能;故选③;
(3)设氢氧化钠的质量为x
2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
80 160 98
x 4.9g
参加反应的氢氧化钠与硫酸铜的质量比是80:160=1:2
$\frac{80}{98}=\frac{x}{4.9g}$
x=4g
氢氧化钠溶液中溶质的质量分数=$\frac{4g}{40g}$×100%=10%
故答案为:(1)Na+、OH-;(2)③;(3)1:2;10%.
点评 化学方程式可以表示出反应中各物质的质量比,根据反应的化学方程式,由反应中任意某物质的质量可计算出反应中其它物质的质量.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
10.下列物质在氧气中燃烧的现象,正确的是( )
| A. | 硫在氧气中燃烧发出淡蓝色火焰,放热 | |
| B. | 红磷在氧气中燃烧产生白雾,放出大量的热 | |
| C. | 木炭燃烧生成二氧化碳,倒入瓶中的澄清石灰水变浑浊 | |
| D. | 红热的铁丝在氧气中燃烧火星四射,放热,生成黑色物质 |
11.下列描述物质的性质中属于化学性质的是( )
| A. | 干冰能做制冷剂 | B. | 浓盐酸容易挥发 | ||
| C. | 氢氧化钠在空气中易变质 | D. | 水蒸发产生水蒸气 |
15.下列说法不正确的是( )
| A. | 向稀硫酸中滴加酚酞试液,溶液显红色 | |
| B. | 酸性溶液的pH小于7 | |
| C. | 紫色石蕊试液遇碱溶液变蓝色 | |
| D. | 纯水的pH一定等于7 |
5.在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水.某课外兴趣小组对生成物中碳的氧化物种类等问题进行了如下探究:
【提示】①CO2+2NaOH═Na2CO3+H2O;②NaOH易溶于水;③浓硫酸能吸水.
【提出问题】生成物中有哪几种碳的氧化物?
【设计实验】兴趣小组同学设计了如下实验:

【实验探究】
(1)观察到A装置(填字母)中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成.该装置中发生反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O.
(2)观察到:①C装置中澄清石灰水不变浑浊,F装置中澄清石灰水变浑浊;
②E装置中出现红色粉末变成黑色的现象.上述现象都能分别证明草酸分解的气体中含有CO.其中E装置中发生反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
【实验结论】猜测3成立.
【提示】①CO2+2NaOH═Na2CO3+H2O;②NaOH易溶于水;③浓硫酸能吸水.
【提出问题】生成物中有哪几种碳的氧化物?
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有CO2 | CO和CO2 |

【实验探究】
(1)观察到A装置(填字母)中的澄清石灰水变浑浊,证明草酸分解有CO2气体生成.该装置中发生反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O.
(2)观察到:①C装置中澄清石灰水不变浑浊,F装置中澄清石灰水变浑浊;
②E装置中出现红色粉末变成黑色的现象.上述现象都能分别证明草酸分解的气体中含有CO.其中E装置中发生反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
【实验结论】猜测3成立.
12.日常生活中的下列变化,属于物理变化的是( )
| A. | 香水挥发 | B. | 蜡烛燃烧 | C. | 食物腐败 | D. | 钢铁生锈 |
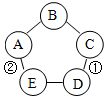 如图表示的物质A~E相互的关系(“-”表示两端的物质能发生化学反应).其中A广泛用于玻璃、造纸、纺织和洗涤剂的生产等;C是一种蓝色溶液;D是使用最多的金属材料.
如图表示的物质A~E相互的关系(“-”表示两端的物质能发生化学反应).其中A广泛用于玻璃、造纸、纺织和洗涤剂的生产等;C是一种蓝色溶液;D是使用最多的金属材料.