题目内容
1.建立“宏观-微观-符号”之间的联系是化学学科的重要特点.(1)用化学符号和数字表示下列微粒.
2个氢原子2H;2个二氧化硫分子2SO2;2个硝酸根离子2NO3-.
(2)“水循环”和“碳循环”是自然界中存在的两大重要循环.
①从微观的角度看:水分子是由氢原子和氧原子构成.
②从宏观的角度看:二氧化碳是由碳元素和氧元素组成.
分析 本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
解答 解:(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个氢原子,就可表示为:2H;
分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,所以2个二氧化硫分子可表示为:2SO2;
离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故2个硝酸根离子可表示为:2NO3-;
(2)①从微观的角度看:水分子是由氢原子和氧原子构成的;
②从宏观的角度看:二氧化碳是由碳元素和氧元素组成的.
故答案为:(1)2H;2SO2;2NO3-;(2)①氢原子和氧原子;②碳元素和氧元素
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.

练习册系列答案
相关题目
12.下列有关分子的说法中,不正确的是( )
| A. | 分子的质量和体积都很小 | B. | 温度升高,分子的体积变大 | ||
| C. | 分子在不停地运动 | D. | 温度越高,分子运动速率越快 |
16.下列实验操作正确的是( )
| A. |  稀释浓硫酸 | B. |  滴加液体 | C. |  取固体药品 | D. |  点燃酒精灯 |
3.某同学家中有一袋化肥,可能混入了其他化肥,且化肥包装袋上字迹模糊.该同学进行了如下探究,请你参与探究并填空:
【提出问题】该化肥中含有什么物质?
【收集信息】经询问得知,该化肥可能为铵态氮肥.
【提出猜想】该化肥所含的阴离子可能是Cl-、CO32-、SO42-中的一种或几种.
【实验、记录与分析】
【实验结论】若该化肥中只含有一种阳离子,则其中一定含有的物质是(写化学式):
(NH4)2SO4和NH4Cl.
【实验反思】在步骤(2)中,产生的白色沉淀是硫酸钡;若用氯化钡溶液代替硝酸钡溶液否(选填“是”或“否”)可行,请简要说明原因:氯化钡代替硝酸钡则影响氯离子的检验.
【提出问题】该化肥中含有什么物质?
【收集信息】经询问得知,该化肥可能为铵态氮肥.
【提出猜想】该化肥所含的阴离子可能是Cl-、CO32-、SO42-中的一种或几种.
【实验、记录与分析】
| 实验操作步骤 | 实验现象 | 实验分析 |
| (1)取少量该化肥样品和少量氢氧化钙放在研钵中混合研磨 | 产生有刺激性气味的气体 | 含有铵根离子 |
| (2)另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加少量稀硝酸,过滤. | 产生白色沉淀, 且沉淀不溶解. | 没有碳酸根离子存在 |
| (3)取(2)所得滤液少量于试管中,滴加硝酸银溶液 | 产生白色沉淀 | 有Cl- |
(NH4)2SO4和NH4Cl.
【实验反思】在步骤(2)中,产生的白色沉淀是硫酸钡;若用氯化钡溶液代替硝酸钡溶液否(选填“是”或“否”)可行,请简要说明原因:氯化钡代替硝酸钡则影响氯离子的检验.
10.以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图.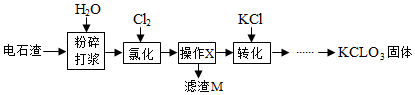
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】

查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】
| 实验步骤 | 实验现象 | 结论 |
| 步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入几滴无色酚酞试液; | 观察到溶液变红色现象 | 猜想①不正确 |
| 步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到固体溶解并有气泡产生现象 | 猜想③正确 |
8.下列有关金属材料说法正确的是( )
| A. | 铁片在海水中不易生锈 | B. | 钢是纯铁 | ||
| C. | 铝片表面易生成一层致密的氧化膜 | D. | 纯铜硬度高于黄铜(铜锌合金) |




