题目内容
14.蜡烛点燃前.观察蜡烛,它的颜色是白色、状态是固态、形状是一般为圆柱体,硬度是小,气味是轻微;从蜡烛上切下一块石蜡,把它放入水中,它不溶于水(填“溶”或“不溶”),由把蜡烛放入水中,蜡烛浮在水面上实验证明,石蜡的密度比水小(填“大”或“小”)分析 根据蜡烛的有关知识结合实验现象分析解答,从而得出结论.
解答 解:蜡烛是由石蜡和棉线烛芯组成的,蜡烛的颜色是白色,状态是固态,形状一般为圆柱体.硬度较小,气味是轻微,蜡烛不溶于水,把蜡烛放入水中,蜡烛浮在水面,蜡烛的密度比水小.
故答案为:白色;固态;一般为圆柱体;小;轻微;不溶;把蜡烛放入水中,蜡烛浮在水面上;小;
点评 本题属于实验探究题,解答时要根据实验现象细心分析、判断,从而得出正确的结论.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列实验方案或操作中,正确的是( )
| A. | 按溶解、过滤、洗涤、蒸发结晶的操作顺序,可分离氯化钾和二氧化锰的混合物 | |
| B. | 用燃烧的木条即可把N2、O2和CO2区别开来 | |
| C. | 测定某溶液pH的操作是:将pH试纸直接插入待测液中,再取出与标准比色卡对照 | |
| D. | 在稀盐酸与氢氧化钠反应后的溶液中滴加酚酞溶液不变色,可断定两者恰好完全反应 |
5. 如图是用模型来表示物质发生化学变化过程的微观示意图.该图示所表示的化学反应的基本类型是( )
如图是用模型来表示物质发生化学变化过程的微观示意图.该图示所表示的化学反应的基本类型是( )
 如图是用模型来表示物质发生化学变化过程的微观示意图.该图示所表示的化学反应的基本类型是( )
如图是用模型来表示物质发生化学变化过程的微观示意图.该图示所表示的化学反应的基本类型是( )| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
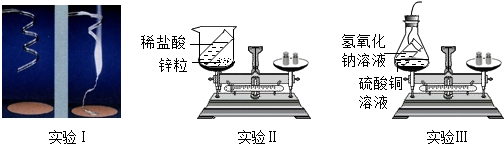
9.某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
【提出假设】物质发生化学反应前后,其总质量相等(或不变)
【实验验证】
实验I:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量
实验II:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量.
实验III:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后设法将两种溶液接触,过一会再称量.
数据见下表:
(1)在实验I中,反应后的质量比反应前明显增加,请用质量守恒定律加以解释根据质量守恒定律,参加反应的镁带和氧气的质量总和,等于反应后生成的氧化镁的质量,由于空气中的氧气参与了反应,因此,生成氧化镁的质量比原来镁带的质量增加了
(2)实验II中出现的现象是锌粒逐渐溶解,并有气泡冒出
(3)实验III的化学方程式是2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
(4)这三个实验中,实验III正确反映了反应物与生成物之间的质量关系.请从分子、原子的角度解释反应前后质量相等的原因化学反应前后原子的种类、数目和质量没有发生改变
(5)实验I、II不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路实验I应将镁条放在密闭的金属容器中引燃,再称量.

【提出假设】物质发生化学反应前后,其总质量相等(或不变)
【实验验证】
实验I:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量
实验II:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量.
实验III:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后设法将两种溶液接触,过一会再称量.
数据见下表:
| 编号 | 实验I | 实验II | 实验III |
| 反应前/g | 4.8 | 112.6 | 118.4 |
| 反应后/g | 8.0 | 112.4 | 118.4 |
(2)实验II中出现的现象是锌粒逐渐溶解,并有气泡冒出
(3)实验III的化学方程式是2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
(4)这三个实验中,实验III正确反映了反应物与生成物之间的质量关系.请从分子、原子的角度解释反应前后质量相等的原因化学反应前后原子的种类、数目和质量没有发生改变
(5)实验I、II不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路实验I应将镁条放在密闭的金属容器中引燃,再称量.

