题目内容
20. 已知A、B、C、D四种物质都是含有同种金属元素的不同化合物,其中B是
已知A、B、C、D四种物质都是含有同种金属元素的不同化合物,其中B是一种常见的建筑材料,A、D含有两种元素,B、C含有三种元素,反应④是
放热反应,它们之间的转化关系如图所示,下列推理不正确的是( )
| A. | 反应③一定是中和反应 | B. | 反应①属于分解反应 | ||
| C. | 物质C可用于改良酸性土壤 | D. | 反应②可以由多个化学反应实现 |
分析 根据A、B、C、D四种物质都是含有同种金属元素的不同化合物,其中B是一种常见的建筑材料,则B为碳酸钙;由A、D含有两种元素,B、C含有三种元素,反应④是放热反应,说明了A为氧化钙,能与水反应放出热生成了氢氧化钙,C为氢氧化钙;氢氧化钙能与盐酸酸等反应生成可氯化钙,D可以为氯化钙,据此分析判断有关的问题.
解答 解:由题意可知,A、B、C、D四种物质都是含有同种金属元素的不同化合物,其中B是一种常见的建筑材料,则B为碳酸钙;由A、D含有两种元素,B、C含有三种元素,反应④是放热反应,说明了A为氧化钙能与水反应放出热生成了氢氧化钙,C为氢氧化钙;氢氧化钙能与盐酸酸反应生成可氯化钙,D可以为氯化.代入题中验证,符合题意.
A、氢氧化钙与氯化镁反应可以生成了氯化钙,不是中和反应,故A错误;
B、碳酸钙高温分解生成了氧化钙,属于分解反应,故B正确;
C、物质C是氢氧化钙,可用于改良酸性土壤,故C正确;
D、氢氧化钙转化为碳酸钙,可以由多个化学反应实现,故D正确.
故选A.
点评 本题属于推断题,解题的关键是照准推断的突破口,根据物质的性质和转化关系逐渐得出结论,然后带入验证即可.

练习册系列答案
相关题目
10.下列实验能达到目的是( )
| A. |  测定空气中氧气含量 | B. |  探究分子运动 | ||
| C. |  探究燃烧条件 | D. |  探究铁锈蚀条件 |
11.如图是两组物质之间在一定的条件下相互转化的过程.下列说法不正确的是( )

| A. | 物质X可供给呼吸 | |
| B. | 绿色植物通过光合作用,将太阳能转化成化学能 | |
| C. | 该转化可以维持自然界中的二氧化碳和氧气的相对平衡 | |
| D. | C6H12O6与X反应生成CO2和H2O属于置换反应 |
15.下列关于碳及其化合物的说法正确的是( )
| A. | 室内放一盆水能防止一氧化碳中毒 | |
| B. | 有机物一定是含有碳、氢、氧的化合物 | |
| C. | 大气中二氧化碳消耗的途径主要是绿色植物的光合作用 | |
| D. | 金刚石、石墨是碳的单质,而C60则是碳的化合物 |
5.某校化学兴趣小组利用下列仪器在实验室进行制取O2的相关实验探究,请回答下列问题.

(1)甲小组用MnO2、KClO3两种药品制取干燥的O2,需选用的仪器组合是BE,反应结束后回收MnO2固体,操作依次是冷却至室温、溶解、过滤、洗涤、烘干.
(2)乙小组探究Fe2O3能否作为H2O2分解的催化剂.实验时间为30s(H2O2过量),其他可能影响实验的因素均保持不变,相关数据如下:
通过比较a和b(填“a”“b”“c”)的大小,可证明Fe2O3在实验中起催化作用,写出该反应的化学方程式2H202$\frac{\underline{\;Fe_{2}O_{3}\;}}{\;}$2H20+O2↑.其次需补做实验,验证反应前后Fe2O3的化学性质不变和验证反应前后Fe2O3的质量不变.
(3)丙小组探究MnO2的用量对H2O2分解速率的影响.每次均用30mL10%的H2O2溶液,使用不同质量的MnO2作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同):
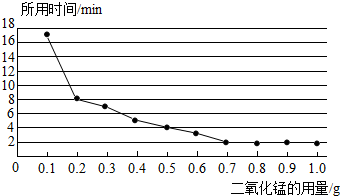
由图可知,MnO2的用量对H2O2分解速率影响的规律是①在一定范围内,MnO2的用量越大,H2O2分解速率越快;
②MnO2的用量超出一定范围后,其用量再增大,反应速率不再继续加快.

(1)甲小组用MnO2、KClO3两种药品制取干燥的O2,需选用的仪器组合是BE,反应结束后回收MnO2固体,操作依次是冷却至室温、溶解、过滤、洗涤、烘干.
(2)乙小组探究Fe2O3能否作为H2O2分解的催化剂.实验时间为30s(H2O2过量),其他可能影响实验的因素均保持不变,相关数据如下:
| 实验序号 | 10%的H2O2 溶液(mL) | 溶液中加入 物质(g) | 收集到气体的 体积(mL) |
| 1 | 100 | 无 | a |
| 2 | 100 | Fe2O30.5g | b |
| 3 | 100 | MnO20.5g | c |
(3)丙小组探究MnO2的用量对H2O2分解速率的影响.每次均用30mL10%的H2O2溶液,使用不同质量的MnO2作催化剂,测定每次收集到500mL O2所用的时间.结果如图(其他实验条件相同):

由图可知,MnO2的用量对H2O2分解速率影响的规律是①在一定范围内,MnO2的用量越大,H2O2分解速率越快;
②MnO2的用量超出一定范围后,其用量再增大,反应速率不再继续加快.
 如图为实验室常用的铁架台示意图.
如图为实验室常用的铁架台示意图. 硝酸钾固体与氯化钾固体的溶解度曲线如图所示,回答下列问题:
硝酸钾固体与氯化钾固体的溶解度曲线如图所示,回答下列问题: