题目内容
6.李克强总理在今年的政府工作报告中提出,要在960万平方公里土地上掀起“大众创业,万众创新”的新浪潮,“万众创新”已成为新常态经济的必然选择.某化学兴趣小组为探究二氧化碳与氢氧化钠反应,设计了如下创新实验方案:| 实验装置 | 实验步骤及操作 | 实验现象 |
 | ①将注射器1中的溶液推入充有CO2的瓶中 | 气球鼓起 |
| ②… | 无明显现象 | |
| ③将注射器2中的溶液推入瓶中 | 溶液中有气泡产生,气球变瘪 | |
| ④向外拉注射器3 | 澄清石灰水变浑浊 |
(2)步骤①中气球鼓起的原因可能是NaOH溶液吸收CO2装置内压强变小,气球鼓起.
(3)步骤②的目的是证明步骤①中装置内的CO2已被完全吸收,其操作方法是向外拉注射器3.
(4)步骤③中发生反应的化学方程式为Ca(OH)2+CO2═H2O+CaCO3↓.
(5)本实验的结论是CO2能与氢氧化钠反应.
分析 (1)实验前要检查装置的气密性;
(2)根据氢氧化钠与二氧化碳反应,使瓶内气压减小考虑;
(3)为了验证二氧化碳是否被全部吸收,所以向外拉注射器1(或充分振荡),即可;
(4)根据方程式的书写方法进行书写.
解答 解:(1)实验前要检查装置的气密性,以防止生成的气体外逸或进入,
(2)NaOH溶液吸收CO2装置内压强变小,在外界大气压的作用下气球鼓起;
(3)向外拉注射器3(或充分振荡),如果无任何现象,证明步骤1中装置内的CO2已被完全吸收;
(4)二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,碳酸钙后面标上沉淀符号,所以化学方程式是:Ca(OH)2+CO2═H2O+CaCO3↓;
故答案为:(1)检查装置的气密性;(2)NaOH溶液吸收CO2装置内压强变小,气球鼓起;
(3)向外拉注射器3(或充分振荡);
(4)Ca(OH)2+CO2═H2O+CaCO3↓.
点评 解答本题关键是要知道氢氧化钠与二氧化碳反应后,使瓶内压强减小,熟悉方程式的书写方法.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
14.下列物质的化学式、名称、俗名与类别完全对应的是( )
| A. | NaOH 氢氧化钠 火碱 碱 | |
| B. | Na2CO3 碳酸氢钠 纯碱 盐 | |
| C. | CaO 氢化钙 熟石灰 氧化物 | |
| D. | NaCl2 氯化钠 食盐 盐 |
1.下列除去杂质的方法中,正确的是( )
| 物质 | 杂质 | 除杂质的试剂和方法 | |
| A | NaOH | Na2CO3 | 加入适量的稀盐酸,蒸发 |
| B | CaO | CaCO3 | 高温煅烧后冷却 |
| C | FeCl2 | CuCl2 | 溶解,过滤,蒸发 |
| D | Zn | Cu | 加入足量稀盐酸后过滤 |
| A. | A | B. | B | C. | C | D. | D |
11.下列物质的名称、化学式和所属的类别不正确的是( )
| A. | 甲烷、CH4 有机物 | B. | 熟石灰、CaCO3、盐 | ||
| C. | 汞、Hg,金属单质 | D. | 氧化钠、Na2O、金属氧化物 |
18.下列实验所残留的物质可以用稀盐酸除掉的是( )
①氢气还原氧化铜后残留在试管上的红色物质
②二氧化碳通入澄清石灰水后附在试管壁上的白色物质
③氢氧化钠溶液滴入盛有氯化铁溶液的试管上附着的红褐色物质
④稀硫酸溶液滴入盛有硝酸钡溶液的试管上附着的白色物质
⑤碳酸钠溶液滴入盛有氯化钡溶液的试管上附着的白色物质.
①氢气还原氧化铜后残留在试管上的红色物质
②二氧化碳通入澄清石灰水后附在试管壁上的白色物质
③氢氧化钠溶液滴入盛有氯化铁溶液的试管上附着的红褐色物质
④稀硫酸溶液滴入盛有硝酸钡溶液的试管上附着的白色物质
⑤碳酸钠溶液滴入盛有氯化钡溶液的试管上附着的白色物质.
| A. | ①②③ | B. | ②③⑤ | C. | ②③④ | D. | ③④⑤ |
15.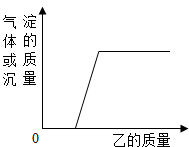 向下表中的甲物质中逐滴加入相应的乙溶液至过量.反应过程中产生的气体或沉淀的质量与加入乙的质量关系,不符合如图曲线描述的是( )
向下表中的甲物质中逐滴加入相应的乙溶液至过量.反应过程中产生的气体或沉淀的质量与加入乙的质量关系,不符合如图曲线描述的是( )
 向下表中的甲物质中逐滴加入相应的乙溶液至过量.反应过程中产生的气体或沉淀的质量与加入乙的质量关系,不符合如图曲线描述的是( )
向下表中的甲物质中逐滴加入相应的乙溶液至过量.反应过程中产生的气体或沉淀的质量与加入乙的质量关系,不符合如图曲线描述的是( )| 序号 | 甲 | 乙 |
| 1 | 硝酸和硝酸镁的混合溶液 | 氢氧化钾溶液 |
| 2 | 铜和锌的合金 | 稀硫酸 |
| 3 | 久置空气中的铝片 | 稀盐酸 |
| 4 | 含有碳酸钠的氢氧化钠溶液 | 稀硝酸 |
| 5 | 盐酸和硫酸的混合溶液 | 硝酸钡溶液 |
| A. | 2、5 | B. | 1、3、4 | C. | 1、2、4 | D. | 1、3、5 |
16.在研究酸的性质时,小明用大小、外形均相同的铝片分别和pH相同的稀盐酸、稀硫酸反应.他意外发现:铝片与盐酸反应放出气泡的速度明显快于与稀硫酸反应放出气泡的速度.是什么原因导致了反应现象的差异呢?小明从微观的角度分析得出:pH相同的盐酸、硫酸,所含的氢离子浓度相同,导致反应现象差异只能是由酸中所含酸根离子的不同引起.于是小明提出了如下的假设:①Cl-能促进铝和酸的反应,SO42-对反应无影响;②Cl-对反应无影响,SO42-能抑制铝和酸的反应;③Cl-能促进铝和酸的反应,SO42-能抑制铝和酸的反应.为了验证假设,小明进行了如表实验探究:
针对小明的上述探究过程,回答下列问题:
(1)从如表的实验探究中,可以得出的结论是Cl-能促进铝和酸的反应,SO42-对反应无影响.
(2)若将第2组实验中添加的试剂NaCl改为HCl,能否完成探究任务?不能(填“能”与“不能”),请说明原因.由于HCl气体溶于水生成盐酸,增加了溶液中氢离子浓度,实验条件发生了变化.
| 组别 | 相同的铝片 | pH=3 的酸 | 反应片刻后添加的试剂(少量) | 添加试剂后的反应现象 |
| 1 | 1g铝片 | 5ml硝酸 | Na2SO4 | 无明显变化 |
| 2 | 1g铝片 | 5ml硝酸 | NaCl | 明显加快 |
(1)从如表的实验探究中,可以得出的结论是Cl-能促进铝和酸的反应,SO42-对反应无影响.
(2)若将第2组实验中添加的试剂NaCl改为HCl,能否完成探究任务?不能(填“能”与“不能”),请说明原因.由于HCl气体溶于水生成盐酸,增加了溶液中氢离子浓度,实验条件发生了变化.
 锌锰电池(俗称干电池)在生活中的用量很大,锌锰电池的构造如图所示.回答下列问题:
锌锰电池(俗称干电池)在生活中的用量很大,锌锰电池的构造如图所示.回答下列问题: