题目内容
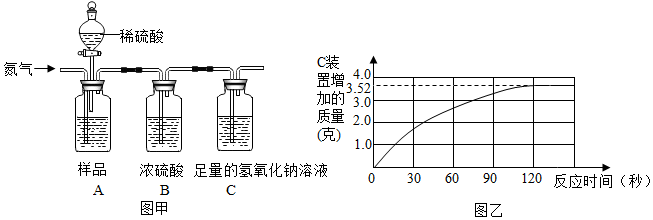
14.实验室用如图所示装置的部分或全部组合后完成如下实验,请回答下列问题:
(1)小明要证明鸡蛋壳的主要成分是碳酸盐,他将A装置中的导气管a与C装置中的导气管d相连,当装置C中产生白色沉淀的现象时即达到实验目的.
(2)用装置A、D组合制取CO2,所选的药品是石灰石、稀盐酸,反应生成的二氧化碳中常混有少量的水蒸气,可将气体通过B装置干燥,这是利用了浓硫酸的吸水性,混合气体应从B装置的b口(填“b”或“c”)通入.
(3)实验小组的同学将A装置制取CO2后的剩余物过滤,除去不溶物,得到溶液,并对此溶液的酸碱性进行了探究.
已知:氯化钙溶液的pH=7
①甲同学向溶液样品中加入酚酞,溶液呈无色,他说:“该溶液呈中性”.他的结论被同学们否定,同学们否定他的理由是酸性和中性的物质均使无色酚酞不变色.
②乙同学向溶液样品中加入紫色石蕊(填写试剂名称),溶液呈红色,由此得出溶液呈酸性的结论,说明溶液中除了有生成的氯化钙以外还有未反应的盐酸;可加入适量的氢氧化钙溶液除去盐酸得到溶质为氯化钙的溶液,写出方程式CaCO3+2HCl═CaCl2+CO2↑+H2O.
分析 (1)根据碳酸盐和酸反应会生成二氧化碳,检验二氧化碳常用澄清石灰水,洗气应该是长进短出进行分析;
(2)根据实验室制取二氧化碳的药品是碳酸钙和稀盐酸,浓硫酸有吸水性,可以干燥气体,洗气应该长进短出进行分析;
(3)根据无色酚酞试剂的特性,紫色石蕊试液遇酸变红进行分析.
解答 解:(1)碳酸盐和酸反应会生成二氧化碳,检验二氧化碳常用澄清石灰水,洗气应该是长进短出,所以将A装置中的导气管a与C装置中的导气管d相连,当装置C中产生白色沉淀的现象时即达到实验目的;
(2)实验室制取二氧化碳的药品是碳酸钙和稀盐酸,浓硫酸有吸水性,可以干燥气体,洗气应该长进短出,混合气体应从B装置的b口通入;
(3))①氯化钙溶液显中性,不能使酚酞溶液变色,氯化钙与盐酸的混合溶液显酸性,也不能使酚酞溶液变色,因而酚酞溶液呈无色,甲同学向溶液样品中加入酚酞,溶液呈无色,他说:“该溶液呈中性”.他的结论被同学们否定,同学们否定他的理由是酸性和中性的物质均使无色酚酞不变色;
②乙同学向溶液样品中加入紫色石蕊试液溶液呈红色,由此得出溶液呈酸性的结论,说明溶液中还有未反应的盐酸;
要加入过量的某物质将盐酸转化为氯化钙,该物质一定不溶于水,若溶于水的话,虽然除去了盐酸,溶液中还会有剩余的该物质,那么该物质可以是碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O.
故答案为:(1)d,白色沉淀;
(2)碳酸钙和稀盐酸,吸水性,b;
(3))①酸性和中性的物质均使无色酚酞不变色;
②紫色石蕊,CaCO3+2HCl═CaCl2+CO2↑+H2O.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

| A. | 禁止使用含碳燃料 | B. | 重污染企业向山区迁移 | ||
| C. | 企业降低本,焚烧处理废电缆 | D. | 加大新能源汽车研发力度 |
| A. |  | B. |  | C. |  | D. |  |
| A. | CH4 | B. | C | C. | CO | D. | CaCO3 |