题目内容
2.硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(氧化铁)等产品的部分流程如图所示:
(1)硫铁矿是混合物(填“纯净”或“混合”).
(2)写出C与Fe3O4反应的化学方程式Fe3O4+2C$\frac{\underline{\;高温\;}}{\;}$3Fe+2CO2↑.
(3)酸浸、过滤后滤液中的溶质主要是硫酸亚铁.
(4)反应I的反应温度一般需控制在35℃以下,其目的是防止碳酸氢铵分解.
(5)在空气中高温煅烧FeCO3生成Fe2O3与CO2,写出该反应的化学反应方程式为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2↑.
分析 (1)硫铁矿属于混合物;
(2)高温条件下,四氧化三铁和碳反应生成铁和二氧化碳;
(3)铁和稀硫酸反应生成硫酸亚铁;
(4)碳酸氢铵受热容易分解;
(5)高温条件下,碳酸亚铁和氧气反应生成氧化铁和二氧化碳.
解答 解:(1)硫铁矿是混合物.
故填:混合.
(2)C与Fe3O4反应的化学方程式为:Fe3O4+2C$\frac{\underline{\;高温\;}}{\;}$3Fe+2CO2↑.
故填:Fe3O4+2C$\frac{\underline{\;高温\;}}{\;}$3Fe+2CO2↑.
(3)酸浸、过滤后滤液中的溶质主要是铁和稀硫酸反应生成的硫酸亚铁.
故填:硫酸亚铁.
(4)反应I的反应温度一般需控制在35℃以下,其目的是防止碳酸氢铵分解.
故填:防止碳酸氢铵分解.
(5)在空气中高温煅烧FeCO3生成Fe2O3与CO2,该反应的化学反应方程式为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2↑.
故填:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2↑.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
16.节约用水,防止水污染是我们每一位公民的义务.下列有关水的说法中正确的是( )
| A. | 为节约用水,可用工业废水浇灌农田 | |
| B. | 自来水常用氯气消毒,所以化工厂排放含氯的水,不会污染环境 | |
| C. | 电解水产生氢气和氧气,质量比为1:8 | |
| D. | H2O2和H2O互称为同素异形体 |
10.下列实验方案中,不合理的是( )
| A. | 用CO2来区分两种无色液体:水和石灰水 | |
| B. | 用点燃的方法除去CO2中混有少量CO | |
| C. | 用灼烧的方法区分两种黑色粉末:木炭粉和氧化铜 | |
| D. | 用过滤的方法除去NaCl溶液中混有的少量大理石 |
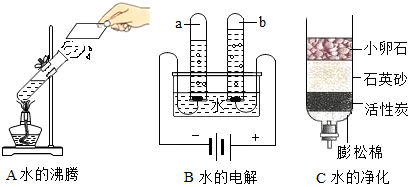
 根据如图电解水的现象,请回答:
根据如图电解水的现象,请回答:

