题目内容
14.钢铁工业是一个国家的支柱产业之一.某同学采集了一些生铁样品(含杂质,杂质不溶于水,不与稀硫酸反应)采用如图甲所示装置进行分析,分别称得锥形瓶与棉花的质量为44.1g,生铁样品的质量为9.0g.在锥形瓶中加入足量稀硫酸后,立即开始记录电子天平的示数,记录数据如图乙,请认真分析数据,回答下列问题.(锥形瓶中发生的化学反应为:Fe+H2SO4═FeSO4+H2↑)
(1)如何判断试验中生铁样品已经完全反应.继续向反应后的滤渣中加入稀硫酸,如果没有气泡冒出,则说明生铁样品已经完全反应.
(2)根据电子天平的数据变化进行分析,如图丙图象中正确的是B.
(3)计算反应后所得溶液中硫酸亚铁的质量分数.
分析 铁和稀硫酸反应生成硫酸亚铁和氢气,根据氢气的质量可以计算生铁中铁的质量和硫酸亚铁的质量,进一步可以计算样品中铁的质量分数和反应后所得溶液中硫酸亚铁的质量分数.
解答 解:(1)铁可以与盐酸反应产生氢气,所以继续向反应后的滤渣中加入稀硫酸,如果没有气泡冒出,则说明生铁样品已经完全反应;故答案为:继续向反应后的滤渣中加入稀硫酸,如果没有气泡冒出,则说明生铁样品已经完全反应;
(2)A、反应结束后,样品中的杂质仍然存在,该选项不正确;
B、生成氢气的质量为:159.0g-158.7g=0.3g,该选项正确;
C、随着反应的进行,溶液质量在增加,该选项不正确.
故填:B.
(2)设铁的质量为x,生成硫酸亚铁的质量为y,
Fe+H2SO4═FeSO4+H2↑,
56 152 2
x y 0.3g
$\frac{56}{x}$=$\frac{152}{y}$=$\frac{2}{0.3g}$,
x=8.4g,y=22.8g,
稀硫酸的质量为:159.0g-44.1g-9.0g=105.9g,
形成溶液的质量为:8.4g+105.9g-0.3g=114g,
反应后所得溶液中硫酸亚铁的质量分数为:$\frac{22.8g}{114g}$×100%=20%,
答:反应后所得溶液中硫酸亚铁的质量分数为20%
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
9.将金属X置于氯化镁溶液中,X表面无固体析出;而将其置于硝酸银溶液中,会发生反应:X+2AgNO3═X(NO3)2+2Ag.由此可判断X、Mg、Ag的金属活动性顺序为( )
| A. | Mg>Ag>X | B. | Ag>X>Mg | C. | Mg>X>Ag | D. | X>Mg>Ag |
19.已知:
①5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4(无色溶液),C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
②SO2能漂白某些有色物质,如将SO2通入品红溶液中,品红溶液褪色.
③一些含硫物质的溶解性(20℃):
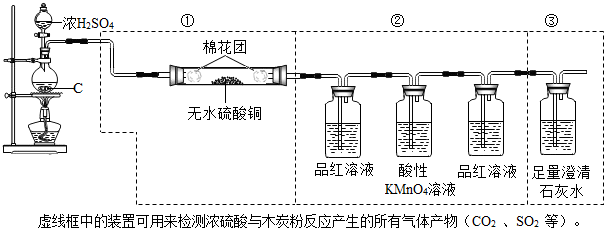
请回答下列问题:
(1)装置中第①部分左端的棉花的作用是缓冲进入的气流,则右端的棉花的作用是防止固体粉末沿导管进入品红溶液.
(2)装置中第①部分的作用是检验是否有水生成,则第②部分最后一个洗气瓶中品红溶液的作用是检验二氧化硫是否被完全除去
(3)若将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则能检出的物质是SO2、CO2.
①5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4(无色溶液),C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
②SO2能漂白某些有色物质,如将SO2通入品红溶液中,品红溶液褪色.
③一些含硫物质的溶解性(20℃):
| 含硫物质 | K2SO4 | MnSO4 | CaSO4 | CaSO3 | FeSO4 | Fe2(SO4)3 |
| 溶解性 | 溶 | 溶 | 微溶 | 难溶 | 溶 | 溶 |

请回答下列问题:
(1)装置中第①部分左端的棉花的作用是缓冲进入的气流,则右端的棉花的作用是防止固体粉末沿导管进入品红溶液.
(2)装置中第①部分的作用是检验是否有水生成,则第②部分最后一个洗气瓶中品红溶液的作用是检验二氧化硫是否被完全除去
(3)若将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则能检出的物质是SO2、CO2.

