题目内容
老师拿出两瓶无标签的试剂,分别是固体和液体,各取少量在试管中混合,立即产生一种无色气体,对该气体展开一系列探究.
(1)此气体是什么气体?验证它的实验方案如下:
(2)产生此气体的化学方程式可能是 .
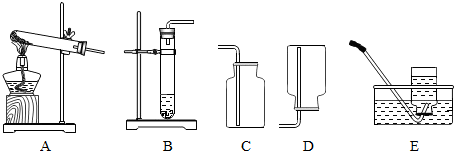
(3)想制取该气体,选用的发生装置可选取图中的 ,收集装置为 .
(4)猜想此气体还可能是另一种气体,可以产生它的化学反应方程式为 .
(1)此气体是什么气体?验证它的实验方案如下:
| 猜想 | 实验步骤 | 现象及结论 |
| 此气体是 |
(3)想制取该气体,选用的发生装置可选取图中的

(4)猜想此气体还可能是另一种气体,可以产生它的化学反应方程式为
考点:常用气体的发生装置和收集装置与选取方法,常见气体的检验与除杂方法,实验室制取氧气的反应原理,二氧化碳的实验室制法,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)并据猜想的气体的性质进行检验;
(2)根据质量守恒定律正确书写化学方程式;
(3)根据初中阶段实验室采用固体和液体反应制取气体的方法分析解答,根据猜想的气体的密度确定气体的收集方法;
(4)根据常见气体的实验室制法,结合(1)中的分析,而确定另外的答案.
(2)根据质量守恒定律正确书写化学方程式;
(3)根据初中阶段实验室采用固体和液体反应制取气体的方法分析解答,根据猜想的气体的密度确定气体的收集方法;
(4)根据常见气体的实验室制法,结合(1)中的分析,而确定另外的答案.
解答:解:(1)在初中阶段我们所学过的实验室制气中,通过固液反应制取气体的,有氧气、氢气、二氧化碳,故该气体可能是三种气体中的一种,以氧气为例解答;检验氧气用带火星的木条伸入瓶中,若木条复燃则是氧气;如果用如图所示装置收集氧气,氧气的密度比空气大;
(2)过氧化氢在二氧化锰作催化剂的条件下生成水和氧气;
(3)制取氧气使用的固体是二氧化锰,使用的液体是过氧化氢溶液,此反应使用液固常温型气体发生装置,氧气不易溶于水,可以使用排水法收集,密度比空气大,可以使用向上排空气法收集;
(4)反应物还得是固液反应制取的气体还有:二氧化碳、氢气,若为二氧化碳,碳酸钙和盐酸反应生成二氧化碳、水和氯化钙,方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.
故答案为:
(1)
(2)产生此气体的化学方程式可能是 2H2O2
2H2O+O2↑;
(3)发生装置可选取下图中的; B; E或是C.
(4)另一种气体,产生它的化学反应方程式为 2HCl+CaCO3═CaCl2+H2O+CO2↑.
(2)过氧化氢在二氧化锰作催化剂的条件下生成水和氧气;
(3)制取氧气使用的固体是二氧化锰,使用的液体是过氧化氢溶液,此反应使用液固常温型气体发生装置,氧气不易溶于水,可以使用排水法收集,密度比空气大,可以使用向上排空气法收集;
(4)反应物还得是固液反应制取的气体还有:二氧化碳、氢气,若为二氧化碳,碳酸钙和盐酸反应生成二氧化碳、水和氯化钙,方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.
故答案为:
(1)
| 猜想 | 实验步骤 | 现象及结论 |
| 此气体是 氧气 | 各取少量固体和液体在试管中混合,然后向试管中插入带火星的木条,观察 | 如果带火星的木条复燃,则说明是氧气. |
| ||
(3)发生装置可选取下图中的; B; E或是C.
(4)另一种气体,产生它的化学反应方程式为 2HCl+CaCO3═CaCl2+H2O+CO2↑.
点评:本题考查了气体的制取,完成此题,可以依据已有的知识进行.要熟知气体的制取方法,以便灵活应用.

练习册系列答案
相关题目
炭雕(主要成分:木炭)是一种集观赏与空气净化为一体的工艺品.下列说法错误的是( )
| A、炭雕是质轻透明的固体 |
| B、炭雕艺术品可以长久保存 |
| C、炭雕摆放要远离火源 |
| D、炭雕能吸附室内微量的甲醛等有害气体 |
下列实验操作中,正确的是( )
A、 倾倒液体 |
B、 点燃酒精灯 |
C、 取用固体粉末 |
D、 滴加液体 |