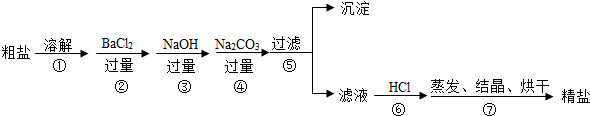
题目内容
16. 如图是a、b两种固体物质的溶解度曲线.
如图是a、b两种固体物质的溶解度曲线.(1)在30℃时,a、b溶解度相等.
(2)20℃时,a物质的溶解度是10g,此时要想在100g水中溶解更多的a物质,可采取的措施是升高温度.
(3)40℃时,将40g a物质放入在100g水中,充分搅拌,所得溶液的质量是130g.
分析 (1)根据溶解度曲线可知,30℃时a、b溶解度相等进行解答;
(2)根据溶解度曲线可知,20℃时,a物质的溶解度是10g以及a物质的溶解度随温度的升高而增大进行解答;
(3)根据40℃时a物质的溶解度为30g进行解答.
解答 解:(1)根据溶解度曲线可知,30℃时a、b溶解度相等;故填:30℃;
(2)根据溶解度曲线可知,20℃时,a物质的溶解度是10g,a物质的溶解度随温度的升高而增大,所以此时要想在100g水中溶解更多的a物质,可采取的措施是升高温度;故填:10g;升高温度;
(3)40℃时a物质的溶解度为30g,所以40℃时,将40g a物质放入在100g水中,充分搅拌,最多溶解30ga物质,所得溶液的质量是130g.故填:130.
点评 本题主要考查了通过溶解度曲线查找物质的溶解度、比较物质的溶解度大小等,难度不大,掌握溶解度曲线的意义并会应用即可正确解答.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
14.李兵同学编写的化学小报中有如下标题,其中某标题下文章中的是二氧化硫,该标题可能是( )
| A. | PM2.5与雾霾天气 | B. | 煤气中毒 | ||
| C. | 形成酸雨的罪魁祸首 | D. | 新装修房屋内空气中的杀手 |
15.下列变化是化学变化的是 ( )
| A. | 汽油挥发 | B. | 海水晒盐 | C. | 石蜡融化 | D. | 铁生锈 |
4. 实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
【提出问题1】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:全部是NaOH 猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有NaOH和Na2CO3.
【查阅资料】CO2在饱和碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如表实验方案,请你一起完成下列实验报告.
回答下列问题(1)实验室中,氢氧化钠固体应怎样保存?密封保存
(2)用酚酞试液不能(填“能”或“不能”)检验氢氧化钠变质.
(3)若取少量的固体溶于水,滴加几滴稀盐酸,没有气泡产生.不能(填“能”或“不能”)证明氢氧化钠固体没有变质.
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】小红同学设计如图所示装置(铁架台略去),实验在20℃,101kPa下进行,步骤如下:
①按图连接好装置;
②检查装置气密性
③用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
④向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢钠溶液224mL.
请回答下列问题:
(1)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由避免CO2溶解在水中有损耗,导致测定结果偏低.
(2)试管中原有的空气对实验结果没有明显影响理由是因为试管中原有空气的体积与反应后试管中没有排尽的二氧化碳的体积几乎等同.
(3)变质氢氧化钠样品中碳酸钠的质量分数为53%(20℃,101kPa下,22.4L二氧化碳的质量为44g)
【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2.现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成Na2SO4和NaHCO3、Na2SO4、Na2SO4H2SO4.
 实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.【提出问题1】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:全部是NaOH 猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有NaOH和Na2CO3.
【查阅资料】CO2在饱和碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如表实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| 1)取少量样品溶于水,加入过量的CaCl2溶液 | 白色沉淀产生 | 该反应的化学方程式:CaCl2+Na2CO3=2NaCl+CaCO3 氢氧化钠已经变质 |
| 2)将上述反应后的混合物过滤,取滤液加入酚酞溶液 | 变红 | 证明猜想Ⅲ正确 |
(2)用酚酞试液不能(填“能”或“不能”)检验氢氧化钠变质.
(3)若取少量的固体溶于水,滴加几滴稀盐酸,没有气泡产生.不能(填“能”或“不能”)证明氢氧化钠固体没有变质.
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】小红同学设计如图所示装置(铁架台略去),实验在20℃,101kPa下进行,步骤如下:
①按图连接好装置;
②检查装置气密性
③用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
④向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢钠溶液224mL.
请回答下列问题:
(1)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由避免CO2溶解在水中有损耗,导致测定结果偏低.
(2)试管中原有的空气对实验结果没有明显影响理由是因为试管中原有空气的体积与反应后试管中没有排尽的二氧化碳的体积几乎等同.
(3)变质氢氧化钠样品中碳酸钠的质量分数为53%(20℃,101kPa下,22.4L二氧化碳的质量为44g)
【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2.现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成Na2SO4和NaHCO3、Na2SO4、Na2SO4H2SO4.
11.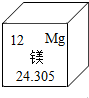 元素周期表是化学学习的工具.如图是镁元素在周期表中的表示,下列有关镁元素的信息不正确的是( )
元素周期表是化学学习的工具.如图是镁元素在周期表中的表示,下列有关镁元素的信息不正确的是( )
 元素周期表是化学学习的工具.如图是镁元素在周期表中的表示,下列有关镁元素的信息不正确的是( )
元素周期表是化学学习的工具.如图是镁元素在周期表中的表示,下列有关镁元素的信息不正确的是( )| A. | 原子序数是12 | B. | 它是金属元素 | ||
| C. | 原子结构示意图为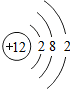 | D. | 镁的相对原子质量是24.305 g |
1.在元素周期表中,应用于计算机芯片的硅元素如图所示,下列硅的说法正确的是( )


| A. | 原子序数是14 | B. | “--”中硅元素符号是SI | ||
| C. | 相对原子质量是14 | D. | 质子数是28.05 |
6.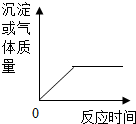 下列实验过程与如图相符的是( )
下列实验过程与如图相符的是( )
 下列实验过程与如图相符的是( )
下列实验过程与如图相符的是( )| A. | 加热氯酸钾 | |
| B. | 向稀硫酸中滴入氯化钡溶液 | |
| C. | 向氯化钠溶液中滴加硝酸钾溶液 | |
| D. | 向装有生锈铁钉的试管中倒入少量稀硫酸 |