题目内容
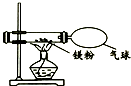
16.研究金属的腐蚀对资源的利用和保护意义重大.(1)为了探究铁锈蚀的条件,进行如图1所示实验.经过一周后观察,试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀.

①通过实验发现:铁锈蚀是铁与氧气和水发生化学反应的过程.
②A中加入的蒸馏水要事先煮沸,其目的是将溶解在水中的氧气赶出.
(2)家中的刀具若沾有食盐水锈蚀更快.为了进一步探究影响铁锈蚀速率的因素,做了如下的实验.
【提出问题】铁锈蚀速率与哪些因素有关.
【查阅资料】①物质溶解在水中得到的混合物称为水溶液,如氯化钠溶解在水中得到氯化钠溶液,乙醇溶解在水中得到乙醇溶液.
②氯化钠溶液能导电;乙醇溶液不能导电.
【猜想】铁的锈蚀速率与下列因素有关:
①反应时的温度;②氧气的含量;③水溶液的导电性.
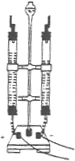
【实验】每次取两套如图2所示的装置,编号为I、II.向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致).
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中. | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II. | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,温度越高,铁的锈蚀速率越快. |
| ②氧气含量 | 在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气. | 铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I<II. | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快. |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇. | 两套装置中铁钉均锈蚀; 且U型管中液面均由b处上升至a处,则所需时间I<II. | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快. |
【反思与提高】
根据该探究实验以及你所学的知识,判断下列说法正确的是AC(填序号).
A.金属的腐蚀是指金属单质与其它物质发生化学反应的过程
B.金属越活泼,就越容易被锈蚀
C.金属腐蚀不一定要有氧气参加.
分析 (1)①根据铁生锈的条件分析;②根据水中能溶解少量的氧气分析;
(2)①根据两套装置中现象分析,即且U型管中液面均由b处上升至a处,则所需时间I>II;②根据氧气的含量越多,铁的锈蚀越快分析;③根据型管中液面均由b处上升至a处,则所需时间I<II分析;
【反思与提高】A、金属锈蚀就是金属与其他物质发生化学反应;B、根据金属铝进行判断;C、根据金属的锈蚀与水溶液的导电性有关.
解答 解:(1)①B中的铁钉与氧气和水充分接触,生锈了,说明铁与氧气和水同时接触时容易生锈.故填:氧气、水.
②因为蒸馏水中溶解有少量的氧气,加热煮沸的目的是把溶解在水中的氧气排出.故填:把溶解在水中的氧气排出.
(2)①根据两套装置中铁钉均锈蚀所需时间I>II,可得出结论:温度越高,铁的锈蚀速率越快
②由结论知,铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快.可设计实验步骤为:在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气,由此得到现象为:铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I<II.
③根据实验现象:两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I<II.则得出的结论为:铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快.
(3)A、金属锈蚀就是金属与其他物质发生化学反应,故A正确;
B、金属越活泼,不一定越容易被锈蚀,如铝,生成一层致密的氧化铝保护膜阻止了铝进一步被氧化,故B错误;
C、由以上实验三可知,金属的锈蚀与水溶液的导电性有关,金属腐蚀不一定要有氧气参加,故C正确;
故答案为:
(1)①水和氧气;②将溶解在水中的氧气赶出;
(2)
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 温度越高,铁的锈蚀速率越快 | ||
| ②氧气含量 | 在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气. | 铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I<II | |
| ③水溶液的导电性 | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快 |
点评 本题主要考查学生对铁生锈的条件这一知识点的掌握情况,尤其强调铁同时直接和氧气、水接触这一点,但还要掌握金属腐蚀不一定要有氧气参加.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 跨流域调水 | B. | 兴修水库 | C. | 节约用水 | D. | 防治水污染 |
 某兴趣小组为了验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为了验证质量守恒定律,做了镁条在空气中燃烧的实验.(1)请写出镁条与氧气反应的化学方程式2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO.
(2)小霖发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律.我不同意
(填“同意”或“不同意”)小霖的观点,因为所有的化学反应都遵循质量守恒定律.
(3)小明同学按如图所示的装置改进实验,验证了质量守恒定律,却发现产物中还有少量淡黄色固体.
[提出问题]淡黄色固体是什么?
| 物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
其他同学认为不必查阅氯化镁的颜色,理由是空气的成分中不含氯元素;
[提出猜想]分析资料,根据颜色判断,李霖认为该淡黄色固体应该是氮化镁,可能是由镁与空气中的氮气反应生成的,反应的化学方程式为3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2.
[实验探究]小霖设计实验证实了自己的猜想,她的方案可能将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体;
[反思与评价]通过上述实验,我们可以发现燃烧不一定需要氧气.
[相关结论]空气中氮气(N2)和氧气(O2)的体积比约为4:1,但镁条在空气中燃烧只生成少量的淡黄色固体,由此得出的一个结论是氮气含量多但是很稳定,难以发生反应.
| A. |  细铁丝在氧气中燃烧 | B. |  氧气验满 | ||
| C. |  点燃酒精灯 | D. |  给物质加热 |
| A. | 镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等 | |
| B. | 按任意体积混合后的氢气和氧气的总质量,跟反应后生成水的质量相等 | |
| C. | 细铁丝在氧气中燃烧后,质量增大,是因为生成物中含有氧的质量 | |
| D. | 煤球燃烧后质量减轻,这不符合质量守恒定律 |
 水是生命之源.
水是生命之源.