题目内容
9.化学实验是学习化学的基础.请根据下列装置图回答问题.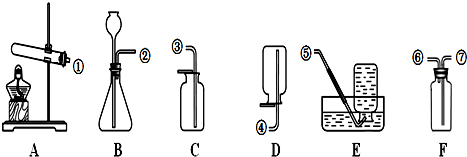
(1)实验室用高锰酸钾制取氧气,选用的气体发生装置是A发生反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,该装置还缺少一团棉花.
(2)实验室用装置B制取CO2,发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
若用装置F收集CO2,则接口②应与⑦ (填接口序号)相连;若在F中加入浓硫酸作干燥剂,用装置B制备干燥的CO2,装置接口的连接顺序为②接⑦,⑥接③.
分析 (1)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气;
为了防止高锰酸钾进入导管,通常在试管口塞一团棉花;
(2)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能够溶于水,密度比空气大.
解答 解:(1)实验室用高锰酸钾制取氧气需要加热,选用的气体发生装置是A,发生反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,为了防止高锰酸钾进入导管,应该在试管口塞一团棉花,因此该装置还缺少一团棉花.
故填:A;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;一团棉花.
(2)实验室用装置B制取CO2,发生反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
若用装置F收集CO2,由于二氧化碳的密度比空气大,则接口②应与⑦相连;
若在F中加入浓硫酸作干燥剂,用装置B制备干燥的CO2,装置接口的连接顺序为②接⑦,⑥接③.
故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;⑦;⑦,⑥;③.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
20.如图是X、Y、Z三种液体的近似pH,下列判断不正确的是( )


| A. | X显酸性 | B. | Z可能是氢氧化钠溶液 | ||
| C. | Y一定是水 | D. | Z可使无色酚酞变红 |
17.下列实验操作中,正确的是( )
| A. | 用滴管滴加液体时,滴管下端要紧贴试管内壁 | |
| B. | 加热试管中的液体应直接加热,不必进行预热 | |
| C. | 用100mL的量筒量取10mL液体 | |
| D. | 向试管里倾倒液体时,试剂瓶紧挨试管口 |
4.初中化学的很多反应可以表示为:甲+乙=丙+丁,其中甲、乙、丙、丁既可能是单质也可能是化合物.下列说法中,正确的是( )
| A. | 若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应 | |
| B. | 若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳 | |
| C. | 若甲、乙、丙分别是酸、碱、盐,则丁一定是水 | |
| D. | 若甲是锌,丙是氢气,则乙一定是稀硫酸 |
14.高芳同学把自制的一种黄色的花汁,分别加入到下列不同的试剂中,并如实记录了观察到的现象
请分析上表,并回答下列问题:
(1)该花汁可以(填可以,不可以)做酸碱指示剂.在盐酸中滴加该花汁,溶液显红色;
(2)雨水在降落过程中常受NO2、SO2的污染形成酸雨,若要测定某雨水的酸碱度是否属于酸雨,可使用pH试纸来测定.
| 试剂 | 食醋 | 蔗糖水 | 蒸馏水 | 肥皂水 | 石灰水 |
| 颜色 | 红 | 黄 | 黄 | 绿 | 绿 |
(1)该花汁可以(填可以,不可以)做酸碱指示剂.在盐酸中滴加该花汁,溶液显红色;
(2)雨水在降落过程中常受NO2、SO2的污染形成酸雨,若要测定某雨水的酸碱度是否属于酸雨,可使用pH试纸来测定.
14. 某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.
某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.
探究1:研究常见的物质--氢氧化钠和盐酸的反应程度.
探究2:研究酸的性质--硫酸、盐酸和锌反应通过探究实验,同学们发现硫酸和盐酸溶液都可以和锌反应产生氢气.产生这种共同现象的原因为硫酸和盐酸溶液中都含有氢离子.
探究3:探索未知--浓硝酸和铜制取气体.
已知Cu+4HNO3(浓)═Cu(NO3)2+2H2O+2NO2↑.NO2能和水反应生成硝酸和NO.NO和NO2都是空气的污染物.
(1)利用该反应制取二氧化氮,其发生装置应选用右图所示装置中的.收集NO2的方法为向上排空气法.
(2)NO为无色气体,其和空气接触会变为红棕色,这是因为NO和空气中的氧气发生化合反应生成了NO2,其反应的化学方程式为:2NO+O2═2N02
探究4:兴趣小组同学向盛有澄清石灰水1000g的大烧杯中加入10g碳酸钠溶液,恰好完全反应后过滤去沉淀,剩余液体总质量为1009.8g,请你计算所加碳酸钠溶液的溶质质量分数?
 某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.
某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.探究1:研究常见的物质--氢氧化钠和盐酸的反应程度.
| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中,加入固体化合物. | (加CaCO3),有气泡产生. | 盐酸过量 |
探究3:探索未知--浓硝酸和铜制取气体.
已知Cu+4HNO3(浓)═Cu(NO3)2+2H2O+2NO2↑.NO2能和水反应生成硝酸和NO.NO和NO2都是空气的污染物.
(1)利用该反应制取二氧化氮,其发生装置应选用右图所示装置中的.收集NO2的方法为向上排空气法.
(2)NO为无色气体,其和空气接触会变为红棕色,这是因为NO和空气中的氧气发生化合反应生成了NO2,其反应的化学方程式为:2NO+O2═2N02
探究4:兴趣小组同学向盛有澄清石灰水1000g的大烧杯中加入10g碳酸钠溶液,恰好完全反应后过滤去沉淀,剩余液体总质量为1009.8g,请你计算所加碳酸钠溶液的溶质质量分数?
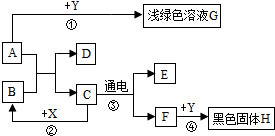 如图所示,A~H是初中化学常见的物质,A和B可发生中和发应,X常用作食品干燥剂,Y为单质.根据图示回答下列问题:
如图所示,A~H是初中化学常见的物质,A和B可发生中和发应,X常用作食品干燥剂,Y为单质.根据图示回答下列问题: