题目内容
10.某同学用锌和稀硫酸做了如下实验,并进行相关的定量分析.将一定量的锌放入试管中,向其中加入98g质量分数为10%的稀硫酸,恰好完全反应.(1)请计算生成氢气的质量(写出计算过程).
(2)通过已知数据还能求出的量有abcd(填字母,符合题意的选项都选).
a.参加反应锌的质量 b.生成硫酸锌的质量
c.稀硫酸中水的质量 d.反应后溶液中溶质质量分数.
分析 (1)根据硫酸的质量,利用反应的化学方程式求得反应放出氢气的质量;
(2)由生成氢气的质量,根据反应的化学方程式,计算出锌的质量,生成硫酸锌的质量,稀硫酸中水的质量,反应后溶液中溶质质量分数.
解答 解:
(1)将一定量的锌放入试管中,向其中加入98g质量分数为10%的稀硫酸,恰好完全反应.消耗稀硫酸中溶质质量=98g×10%=9.8g
设反应放出氢气的质量为x
Zn+H2SO4═ZnSO4+H2↑
98 2
9.8g x
$\frac{98}{9.8g}=\frac{2}{x}$
x=0.2g
(2)由生成氢气的质量,根据反应的化学方程式,计算出锌的质量,生成硫酸锌的质量,反应后溶液中溶质质量分数;
稀硫酸中水的质量可以根据稀硫酸中溶剂质量=溶液质量-溶质质量解答.
答案:
(1)生成氢气的质量为0.2g;
(2)abcd
点评 本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
20.下列说法正确的是( )
| A. | 点燃H2、CO等可燃性气体可能会发生爆炸 | |
| B. | 用乙醇汽油作汽车燃料,不能节能减排 | |
| C. | 用水灭火,主要是降低了可燃物的着火点 | |
| D. | 石油是一种化工产品 |
1.下列变化属于物理变化的是( )
| A. | 大米酿酒 | B. | 铁制品锈蚀 | C. | 浓盐酸挥发 | D. | 蜡烛燃烧 |
18.我们每时每刻都离不开空气.空气中含量最多的气体是( )
| A. | N2 | B. | CO2 | C. | H2 | D. | O2 |
5.化学对环境的保护和改善起着重要作用,下列做法错误的是( )
| A. | 工业废水经处理达标后再排放 | |
| B. | 化石燃料燃烧会造成空气污染,所以禁止使用 | |
| C. | 使用可降解的塑料可以有效缓解“白色污染” | |
| D. | 使用汽油和柴油的汽车为其应采用催化净化装置,将有害气体转化为无害物质 |
15.对宏观事实的微观解释错误的是( )
| A. | 温度升高,水银柱上升,是因为汞原子变大了 | |
| B. | 缉毒犬能发现毒贩,是因为分子是不断运动的 | |
| C. | 稀有气体能做保护气,是因为构成稀有气体的原子最外层达到稳定结构 | |
| D. | 稀盐酸和稀硫酸具有相似的化学性质是因为他们解离出的阳离子都是H+ |
19.下列有关水或溶液的说法正确的是( )
| A. | 用直流电电解水,发现负极与正极上得到的气体体积比约为2:1 | |
| B. | 自来水厂的净水过程中,加入明矾的作用是杀菌消毒 | |
| C. | 为了节约用水,可以用工业废水直接浇灌农田 | |
| D. | 均一、稳定的液体一定是溶液 |
6.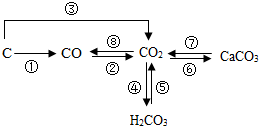 如图是部分含碳物质的转化关系图,根据图示判断下列说法正确的是( )
如图是部分含碳物质的转化关系图,根据图示判断下列说法正确的是( )
 如图是部分含碳物质的转化关系图,根据图示判断下列说法正确的是( )
如图是部分含碳物质的转化关系图,根据图示判断下列说法正确的是( )| A. | ①②③⑧都只能通过化合反应实现 | |
| B. | ⑤⑦均可用于实验室制取CO2 | |
| C. | 将CO2通入紫色石蕊溶液中,溶液变红,可用④来解释原因 | |
| D. | 图中物质均为含碳元素的化合物 |