题目内容
20.化学工业给社会带来巨大财富和众多产品的同时,也带来了环境问题.在化学工业中除了要及时处理好“三废”,还要努力提高原料的利用率,增加产品的产量,降低生产对环境造成的污染,符合“绿色化学”.以铜等原料制取氢氧化铜,下列方案中,“符合绿色化学”的是( )| A. | Cu$\stackrel{+HCl}{→}$CuCl2$\stackrel{+KOH}{→}$Cu(OH)2 | |
| B. | Cu$\stackrel{+O_{2}}{→}$CuO$\stackrel{+H_{2}SO_{4}}{→}$CuSO4$\stackrel{+NaOH}{→}$Cu(OH)2 | |
| C. | Cu$\stackrel{+O_{2}}{→}$CuO$\stackrel{+H_{2}SO_{4}}{→}$CuSO4$\stackrel{+Ba(OH)_{2}}{→}$Cu(OH)2 | |
| D. | Cu$\stackrel{+H_{2}SO_{4}(浓)}{→}$CuSO4$\stackrel{+NaOH}{→}$Cu(OH)2 |
分析 A、铜不能和盐酸反应;
B、铜可以和氧气反应生成氧化铜,氧化铜可以和硫酸反应生成硫酸铜,硫酸铜可以和氢氧化钠反应;
C、铜可以和氧气反应生成氧化铜,氧化铜可以和硫酸反应生成硫酸铜,硫酸铜和氢氧化钡反应生成两种沉淀,无法分离;
D、铜与浓硫酸反应会产生二氧化硫气体.
解答 解:A、铜不能和盐酸反应生成氯化铜,故A方案不正确;
B、铜可以和氧气反应生成氧化铜,氧化铜可以和硫酸反应生成硫酸铜,硫酸铜可以和氢氧化钠发生复分解反应而生成氢氧化铜,故B方案正确;
C、铜可以和氧气反应生成氧化铜,氧化铜可以和硫酸反应生成硫酸铜,硫酸铜和氢氧化钡反应生成两种沉淀,无法分离,错误;
D、铜与浓硫酸反应会产生二氧化硫气体,污染空气,错误.
故选B.
点评 熟练掌握金属活动性顺序;掌握复分解反应发生的条件,熟练的判断酸碱盐之间能否发生复分解反应.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
11.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸的反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
(1)试计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为1:4时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 25 | 25 | 50 |
| 所用稀硫酸的质量/g | 120 | 160 | 100 |
| 生产氢气的质量/g | 0.4 | 0.4 | 0.4 |
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为1:4时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
8. 水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
硝酸钾溶解度
(1)A、B、C中一定是饱和溶液的是B,一定是不饱和溶液的是A;(填字母)
(2)当x=5.8g时,B中恰好没有固体剩余.
 水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答硝酸钾溶解度
| 温度℃ | 0 | 10 | 20 | T2 | 40 | 50 |
| 溶解度g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
(2)当x=5.8g时,B中恰好没有固体剩余.
15.下列离子能在pH=13的水溶液大量共存的是( )
| A. | SO42-、Cl-、Na+、H+ | B. | K+、SO42-、Cu2+、NO3- | ||
| C. | Cl-、K+、SO42-、Na+ | D. | Ca2+、Na+、CO32-、Cl- |
12.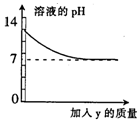 烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )
烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )
 烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )
烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )| x | y | |
| A | NaOH溶液 | 稀HCl(过量) |
| B | 稀H2SO4 | BaCl2溶液(少量) |
| C | Ca(OH)2 | CO2(适量) |
| D | 稀H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
 如图是小柯同学在复习科学时,构建酸通性的“手掌图”.
如图是小柯同学在复习科学时,构建酸通性的“手掌图”.