题目内容
11.从溶质质量分数为10%的氢氧化钠溶液中,取出10克溶液,则剩余溶液的溶质质量分数为( )| A. | 20% | B. | 5% | C. | 8% | D. | 不变 |
分析 根据溶液具有均一性,各部分的性质完全相同,进行分析解答.
解答 解:从溶质质量分数为10%的氢氧化钠溶液中,取出10克溶液,由于溶液具有均一性,各部分的性质完全相同,则剩余溶液的溶质质量分数为10%.
故选:D.
点评 本题难度不大,掌握溶液具有均一性(各部分的性质完全相同)并能灵活运用是正确解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.关于二氧化碳的说法正确的是( )
| A. | 由碳原子和氧原子构成 | B. | 由氧气和碳元素组成 | ||
| C. | 由一个碳原子和两个氧原子构成 | D. | 由碳元素和氧元素组成 |
6. 在t℃时,某固体物质在不同质量的水中达到饱和状态时所溶解的质量绘制成如图中的斜线.下列说法正确的是( )
在t℃时,某固体物质在不同质量的水中达到饱和状态时所溶解的质量绘制成如图中的斜线.下列说法正确的是( )
 在t℃时,某固体物质在不同质量的水中达到饱和状态时所溶解的质量绘制成如图中的斜线.下列说法正确的是( )
在t℃时,某固体物质在不同质量的水中达到饱和状态时所溶解的质量绘制成如图中的斜线.下列说法正确的是( )| A. | 该物质的溶解度随温度的升高而增大 | |
| B. | 在t℃时,该物质的溶解度为50g | |
| C. | 图中m点表示该物质的饱和溶液 | |
| D. | n点表示溶液中溶质的质量分数为25% |
16. 化学学习小组的同学们在探究氢氧化钠的性质时,将CO2通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
化学学习小组的同学们在探究氢氧化钠的性质时,将CO2通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
探究一:CO2是否与氢氧化钠发生了化学反应?
为了证明CO2与氢氧化钠的确发生了化学反应,你选择的物质是c、d、e(填写字母).请任意选择一个能证明CO2与氢氧化钠发生反应的化学方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.
a.无色酚酞溶液 b.硝酸钠溶液 c.硫酸
d.硝酸钡溶液 e.Ba(OH)2溶液
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】
佳佳认为溶质是Na2CO3,贝贝认为溶质是Na2CO3和NaOH.
写出CO2与氢氧化钠反应的化学方程式2NaOH+CO2=Na2CO3+H2O;
【实验验证】
佳佳同学取实验后的溶液滴加酚酞溶液,观察到无色酚酞溶液变红色,则证明自己的猜想正确.该实验设计是否合理不合理,其理由是含有碳酸钠的溶液和含有氢氧化钠的溶液均显碱性,都能使无色酚酞溶液变红;
贝贝为了验证自己的猜想,进行了如下实验,请你补充完整.
【实验反思】
①要除去氢氧化钠中含有的碳酸钠,所用的方法(用化学方程式表示)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
②同学们联想到了氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴加边测定混合溶液的pH.请你分析上述方案中,只强调pH变小为什么要“当测定pH小于或等于7”才可证明发生了反应,其原因是稀硫酸中的水会稀释氢氧化钠,使ph值变小.当ph值小于等于7时,说明氢氧化钠消耗完毕,则说明氢氧化钠和稀硫酸反应.
 化学学习小组的同学们在探究氢氧化钠的性质时,将CO2通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
化学学习小组的同学们在探究氢氧化钠的性质时,将CO2通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.探究一:CO2是否与氢氧化钠发生了化学反应?
为了证明CO2与氢氧化钠的确发生了化学反应,你选择的物质是c、d、e(填写字母).请任意选择一个能证明CO2与氢氧化钠发生反应的化学方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.
a.无色酚酞溶液 b.硝酸钠溶液 c.硫酸
d.硝酸钡溶液 e.Ba(OH)2溶液
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】
佳佳认为溶质是Na2CO3,贝贝认为溶质是Na2CO3和NaOH.
写出CO2与氢氧化钠反应的化学方程式2NaOH+CO2=Na2CO3+H2O;
【实验验证】
佳佳同学取实验后的溶液滴加酚酞溶液,观察到无色酚酞溶液变红色,则证明自己的猜想正确.该实验设计是否合理不合理,其理由是含有碳酸钠的溶液和含有氢氧化钠的溶液均显碱性,都能使无色酚酞溶液变红;
贝贝为了验证自己的猜想,进行了如下实验,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤 ②向滤液滴加适量无色酚酞试液 | ①产生白色沉淀 ②溶液变红 | 贝贝的猜想成立 |
①要除去氢氧化钠中含有的碳酸钠,所用的方法(用化学方程式表示)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
②同学们联想到了氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴加边测定混合溶液的pH.请你分析上述方案中,只强调pH变小为什么要“当测定pH小于或等于7”才可证明发生了反应,其原因是稀硫酸中的水会稀释氢氧化钠,使ph值变小.当ph值小于等于7时,说明氢氧化钠消耗完毕,则说明氢氧化钠和稀硫酸反应.
3.下列各组物质中前者属于化合物,后者属于单质的是( )
| A. | 氧气,稀有气体 | B. | 冰水混合物,食盐水 | ||
| C. | 二氧化碳,液氧 | D. | 澄清石灰水,高锰酸钾 |
20.下表中比较金属活动性强弱的实验设计、现象、结论均正确的是( )
| 选项 | 实验设计 | 现象 | 结论 |
| A | 分别将形状、大小相同的铜丝和银丝放入相同浓度的稀盐酸中 | 铜的表面有气泡产生,银没有 | Cu>Ag |
| B | 分别将质量相同的铝丝和镁片引燃,插入盛有氧气的集气瓶中 | 镁比铝燃烧得更剧烈 | Mg>Al |
| C | 将铁丝插入硫酸铜溶液中 | 铁丝表面变红 | Cu>Fe |
| D | 分别将形状、大小相同的锌片、铁片放入相同浓度的稀硫酸中 | 锌片比铁片产生气泡的速率更快 | Zn>Fe |
| A. | A | B. | B | C. | C | D. | D |
1.如图是水分子在一定条件下分解的示意图,下列说法不正确的是( )

| A. | 一个水分子由两个氢原子和一个氧原子构成 | |
| B. | 水分解后生成氢气和氧气的分子数比为2:1 | |
| C. | 水分解过程中,原子的数目不变 | |
| D. | 水分解过程中,分子的种类不变 |
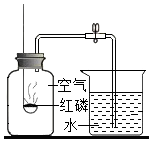 已知空气的主要成份是氮气和氧气.某课外活动小组 设计了测定空气中氧气含量的实验:在燃烧匙内盛过量红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,等红磷火焰熄灭,集气瓶冷却至室温后,再打开水夹.实验装置如图:
已知空气的主要成份是氮气和氧气.某课外活动小组 设计了测定空气中氧气含量的实验:在燃烧匙内盛过量红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,等红磷火焰熄灭,集气瓶冷却至室温后,再打开水夹.实验装置如图: