题目内容
8.铝块能加工成铝箔是利用铝的( )| A. | 导电性 | B. | 延展性 | C. | 可燃性 | D. | 抗腐蚀性 |
分析 物质的性质决定物质的用途,根据金属具有良好的导电性、延展性、导热性,结合事实进行分析解答.
解答 解:A、铝块能加工成铝箔,是利用了铝具有良好的延展性,而不是导电性,故选项错误.
B、铝块能加工成铝箔,是利用了铝具有良好的延展性,故选项正确.
C、铝块能加工成铝箔,是利用了铝具有良好的延展性,而不是可燃性,故选项错误.
D、铝块能加工成铝箔,是利用了铝具有良好的延展性,而不是抗腐蚀性,故选项错误.
故选:B.
点评 本题难度不大,物质的性质决定物质的用途,掌握常见金属的性质和用途是正确解答此类题的关键.

练习册系列答案
相关题目
8.氢气是21世纪极有前途的新型能源,是各国研究的热点之一,如何制取和安全高效使用氢气,是课题的关键,以下研究方向中你认为不可行的是( )
| A. | 寻找特殊材料,安全高效储存氢气 | |
| B. | 设法将太阳能聚焦,产生高温使水分解产生氢气 | |
| C. | 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气 | |
| D. | 寻找新型催化剂,常温下分解水制取氢气 |
6.亮亮做家务时接触到下列用品.
(1)他清理垃圾时发现一袋脱氧剂,拆开后看到还原铁粉已生锈,铁生锈的原因是Fe与潮湿的空气接触.
(2)他选用洁厕灵清除水垢(主要成分是碳酸钙),用化学方程式表示其原理CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)他清晰炉灶时戴上橡胶手套,以防清洁剂与皮肤直接接触,其原因是NaOH有强腐蚀性.
(4)他仔细看了食用白醋的配料表,其中醋酸(化学式为CH3COOH)的含量为5%,则醋酸中碳、氢、氧三种元素的质量比为6:1:8(填最简整数比).
(5)做完家务,他准备测定一下洁厕灵、炉具清洁剂、食用白醋的酸碱度,于是他选用初中化学实验室常用的pH试纸来测定,其中pH>7的是炉具清洁剂.
| 用品 | 脱氧剂 | 洁厕灵 | 炉灶清洁剂 | 低钠盐 | 食用白醋 |
| 有效成分 | 还原铁粉 | 盐酸 | 氢氧化钠 | 氯化钠 | 醋酸 |
(2)他选用洁厕灵清除水垢(主要成分是碳酸钙),用化学方程式表示其原理CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)他清晰炉灶时戴上橡胶手套,以防清洁剂与皮肤直接接触,其原因是NaOH有强腐蚀性.
(4)他仔细看了食用白醋的配料表,其中醋酸(化学式为CH3COOH)的含量为5%,则醋酸中碳、氢、氧三种元素的质量比为6:1:8(填最简整数比).
(5)做完家务,他准备测定一下洁厕灵、炉具清洁剂、食用白醋的酸碱度,于是他选用初中化学实验室常用的pH试纸来测定,其中pH>7的是炉具清洁剂.
3. 某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
老师提示:
I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
探究活动二:测定待测液中氢氧化钠的质量分数
【实验】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:
同学们按如图所示的实验步骤进行实验:
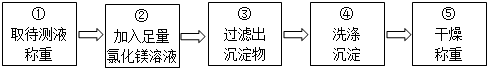
(2)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.步骤④中判断沉淀物是否洗净的具体操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,如果不产生白色沉淀,说明已经洗净,如果产生白色沉淀,说明没有洗净(写出实验步骤、现象和结论).
(5)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.老师提示:
I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 待测液呈碱性,表明含有氢氧化钠. |
【实验】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:
同学们按如图所示的实验步骤进行实验:

(2)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.步骤④中判断沉淀物是否洗净的具体操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,如果不产生白色沉淀,说明已经洗净,如果产生白色沉淀,说明没有洗净(写出实验步骤、现象和结论).
(5)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
20. 钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
[提出假设]A.Ti>Mg>Ag; B.Mg>Ag>Ti; C.Mg>Ti>Ag.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.请填空:
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去氧化膜,利于直接反应.
(2)根据下表中的实验现象填空:
[结论]假设C正确(填“A”或“B”或“C”)
(3)在做镁条与稀盐酸反应过程中观察到产生气体体积与反应时间有如图所示关系:
则t1~t2时间内反应速率逐渐加快的主要原因是反应放热,溶液温度升高使反应速率加快.
t2~t3时间内反应速率逐渐减慢的原因是盐酸溶液的浓度逐渐降低.
(4)在[实验设计]中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确结论?否(填“是”或“否”),理由是反应物的浓度不同,也会影响反应速度.
(5)你是否还知道其他方法来比较这三种金属的活动性(可供选择的药品:Ti、Mg、Ag、TiCl2溶液、MgCl2溶液、AgNO3溶液).
①金属Mg、Ag分别和TiCl2溶液反应;②MgCl2溶液、AgNO3溶液分别和金属Ti反应.
 钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.[提出假设]A.Ti>Mg>Ag; B.Mg>Ag>Ti; C.Mg>Ti>Ag.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.请填空:
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去氧化膜,利于直接反应.
(2)根据下表中的实验现象填空:
| Ti | Mg | Ag | |
| 实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
(3)在做镁条与稀盐酸反应过程中观察到产生气体体积与反应时间有如图所示关系:
则t1~t2时间内反应速率逐渐加快的主要原因是反应放热,溶液温度升高使反应速率加快.
t2~t3时间内反应速率逐渐减慢的原因是盐酸溶液的浓度逐渐降低.
(4)在[实验设计]中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确结论?否(填“是”或“否”),理由是反应物的浓度不同,也会影响反应速度.
(5)你是否还知道其他方法来比较这三种金属的活动性(可供选择的药品:Ti、Mg、Ag、TiCl2溶液、MgCl2溶液、AgNO3溶液).
①金属Mg、Ag分别和TiCl2溶液反应;②MgCl2溶液、AgNO3溶液分别和金属Ti反应.
17. 水是人及一切生物生存所必需的,我国人均水量约为世界人均水量的四分之一,许多地区已出现因水资源短缺影响人民生活.请你根据下表提供的水资源紧缺指标,判断如图所列我国部分省市中属于中度缺水省份的是( )
水是人及一切生物生存所必需的,我国人均水量约为世界人均水量的四分之一,许多地区已出现因水资源短缺影响人民生活.请你根据下表提供的水资源紧缺指标,判断如图所列我国部分省市中属于中度缺水省份的是( )
 水是人及一切生物生存所必需的,我国人均水量约为世界人均水量的四分之一,许多地区已出现因水资源短缺影响人民生活.请你根据下表提供的水资源紧缺指标,判断如图所列我国部分省市中属于中度缺水省份的是( )
水是人及一切生物生存所必需的,我国人均水量约为世界人均水量的四分之一,许多地区已出现因水资源短缺影响人民生活.请你根据下表提供的水资源紧缺指标,判断如图所列我国部分省市中属于中度缺水省份的是( )| 紧缺度 | 人均水量(m3/年) |
| 轻度缺水 | 1 700-3 000 |
| 中度缺水 | 1 000-1 700 |
| 重度缺水 | 500-1 000 |
| 极度缺水 | <500 |
| A. | 天津 | B. | 河北 | C. | 陕西 | D. | 黑龙江 |





