题目内容
17.下表是氯化钠、硝酸钾在不同温度时的溶解度.据此判断:下列说法不正确的是( )| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| A. | 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交 | |
| B. | 在20℃时,向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18% | |
| C. | 从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法 | |
| D. | 分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液 |
分析 根据固体的溶解度表可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:A、氯化钠和硝酸钾的溶解度在20℃~30℃温度范围内分别从36g--36.3g、31.6g--45.8g,所以曲线会相交,故A正确;
B、在20℃时,氯化钠的溶解度是36g,所以68g的饱和氯化钠溶液中含有氯化钠18g,所以向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为$\frac{16g}{100g}$×100%=18%,故B正确;
C、氯化钠的溶解度受温度的影响变化较小,所以从含有少量硝酸钾的饱和氯化钠溶液中得到较多的氯化钠晶体,通常可采用蒸发溶剂使其结晶的方法,故正确.
D、升高温度,氯化钠、硝酸钾的溶解度增大,20℃时的饱和氯化钠溶液的溶质质量分数大于饱和硝酸钾溶液的溶质质量分数,所以分别将20℃时的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,饱和氯化钠溶液的溶质质量分数仍大于饱和硝酸钾溶液的溶质质量分数,故错误;
故选:D.
点评 本题难度不是很大,主要考查了固体的溶解度表所表示的意义,及根据固体的溶解度表来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
18.下列化学用语与正确的是( )
| A. | 2个氢原子:2H | B. | 氧分子:O | C. | 铜离子:Cu2+ | D. | 硫酸钠:NaSO4 |
2.下列化学方程式中,书写正确的是( )
| A. | HgO2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+O2↑ | B. | Al+2HCl═AlCl3+H2↑ | ||
| C. | Cu+FeSO4═CuSO4+Fe | D. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ |
9.下列物质的鉴别方法中不正确的是( )
| 选项 | 鉴别的物质 | 鉴别的方法 |
| A | 冰和干冰 | 室温(20℃)放置,观察是否有痕渍 |
| B | 水和双氧水 | 加入二氧化锰,观察是否有气泡 |
| C | 硬水和软水 | 加入肥皂水,观察产生泡沫的多少 |
| D | 氦气和二氧化碳 | 用燃着的木条,观察木条是否继续燃烧 |
| A. | A | B. | B | C. | C | D. | D |
6.实验室常用下列装置来制取、收集气体.仪器b是分液漏斗,可通过旋转活塞分次滴加液体.请回答以下问题.
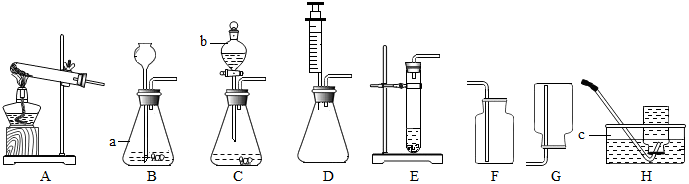
(1)仪器a、c的名称是:a锥形瓶,c水槽.
(2)实验室用氯酸钾制取氧气,应选用的发生装置和收集装置的组合为AF或AH(填字母序号),该反应的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.收集装置的选择是由气体的性质决定的.既能用排水法也能用排空气法收集的气体一定具有的性质有①③④(填数字序号).
①难溶于水 ②易溶于水 ③不与水反应 ④密度与空气不接近
⑤可与空气中某成分反应 ⑥有毒,是一种大气污染物
(3)实验室要制取少量CO2应选择的较简单的发生装置是E(填字母序号).
某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊,请将可能的原因填入如表(答出一条即可),并用简单的实验进行验证:
(4)常温下块状电石(CaC2)与水反应生成乙炔(C2H2)气体和氢氧化钙,该反应的化学方程式是CaC2+2H2O=Ca(OH)2+C2H2↑.实验室制取乙炔时,须严格控制加水速度,以免剧烈反应放热引起装置炸裂.上图中适合制取乙炔气体的发生装置有CD
(填装置序号).
(5)通过查阅资料得知:
①氨气是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;
②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体.
小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生和收集装置是AG(填字母),发生反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
③请写出氨气和氧化铜反应的化学方程式2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.

(1)仪器a、c的名称是:a锥形瓶,c水槽.
(2)实验室用氯酸钾制取氧气,应选用的发生装置和收集装置的组合为AF或AH(填字母序号),该反应的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.收集装置的选择是由气体的性质决定的.既能用排水法也能用排空气法收集的气体一定具有的性质有①③④(填数字序号).
①难溶于水 ②易溶于水 ③不与水反应 ④密度与空气不接近
⑤可与空气中某成分反应 ⑥有毒,是一种大气污染物
(3)实验室要制取少量CO2应选择的较简单的发生装置是E(填字母序号).
某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊,请将可能的原因填入如表(答出一条即可),并用简单的实验进行验证:
| 可能的原因 | 实验步骤 | 实验现象 | 实验结论 |
| 猜想的结论正确 |
(填装置序号).
(5)通过查阅资料得知:
①氨气是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;
②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体.
小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生和收集装置是AG(填字母),发生反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
③请写出氨气和氧化铜反应的化学方程式2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.