题目内容
11.称取3.2g表面被氧化的镁条,放入100g稀盐酸中恰好完全反应,生成气体0.2g.求:(1)此镁条中金属镁的质量.(写计算过程)
(2)求反应后所得溶液的溶质质量分数.(计算结果保留一位小数)
分析 氧化镁和稀盐酸反应生成氯化镁和水,镁和稀盐酸反应生成氯化镁和氢气,
根据生成氢气的质量可以计算镁的质量,进一步可以计算氧化镁的质量,从而可以计算反应后所得溶液的溶质质量分数.
解答 解:(1)设镁的质量为x,生成氯化镁的质量为y,
Mg+2HCl═MgCl2+H2↑,
24 95 2
x y 0.2g
$\frac{24}{x}$=$\frac{95}{y}$=$\frac{2}{0.2g}$,
x=2.4g,y=9.5g,
答:镁的质量是2.4g.
(2)设氧化镁和稀盐酸反应生成氯化镁的质量为z,
MgO+2HCl═MgCl2+H2O,
40 95
3.2g-2.4g z
$\frac{40}{3.2g-2.4g}$=$\frac{95}{z}$,
z=1.9g,
反应后所得溶液的溶质质量分数为:$\frac{9.5g+1.9g}{3.2g+100g-0.2g}$×100%=11.1%,
答:反应后所得溶液的溶质质量分数为11.1%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
1.下列过程中,没有发生化学变化的是( )
| A. | 木炭燃烧 | B. | 剩饭变馊 | C. | 冰棒融化 | D. | 火药爆炸 |
19.自来水是我国目前主要的生活饮用水,下表是我国颁布的生活饮用水水质标准的部分内容.
(1)感官指标表现的是自来水的物理(填“物理”或“化学”>性质;化学指标中的铜、铁是指元素(填“元素”或“单质”);若化学指标中的pH=8时,表明自来水呈碱性(填“酸性”“碱性”或“中性”).
(2)若要测定自来水的酸碱性强弱,最适宜的是B(填字母).
A.酚酞溶液 B.pH试纸 C石蕊溶液
(3)自来水厂常用的消毒剂有二氧化氯(ClO2)、漂白粉[Ca(ClO)2]、“84消毒液”(NaClO)等.工业上制取漂白粉的化学方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,制取“84消毒液”是将氯气通入烧碱溶液中,反应原理与漂白粉的制取相似,请写出该反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
(4)实验室用自来水制取蒸馏水的方法是D.
A吸附 B沉淀 C过滤 D.蒸馏
(5)长期饮用蒸馏水不利于(填“利于”或“不利于”)人体健康.
| 项目 | 标准 |
| 感官指标 | 无异味、异臭等 |
| 化学指标 | pH6.5-8.5,铜<1.0mg•L-1,氟化物<1.0mg•L-1,游离氯≥0.3mg•L-1等 |
(2)若要测定自来水的酸碱性强弱,最适宜的是B(填字母).
A.酚酞溶液 B.pH试纸 C石蕊溶液
(3)自来水厂常用的消毒剂有二氧化氯(ClO2)、漂白粉[Ca(ClO)2]、“84消毒液”(NaClO)等.工业上制取漂白粉的化学方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,制取“84消毒液”是将氯气通入烧碱溶液中,反应原理与漂白粉的制取相似,请写出该反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
(4)实验室用自来水制取蒸馏水的方法是D.
A吸附 B沉淀 C过滤 D.蒸馏
(5)长期饮用蒸馏水不利于(填“利于”或“不利于”)人体健康.
6.活性氧化锌(ZnO)是一种面向21世纪的新型高功能精细无机产品,近几年有关该物质的制备成为化工行业研究的热点.某校化学兴趣小组的同学参观了某厂用粗ZnO制备活性ZnO的生产流程,做如下探究.
制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:

查阅资料:A.粗ZnO中常含杂质FeO、CuO
B.反应3是为了制得碱式碳酸锌,碱式碳酸锌经焙烧可制得活性ZnO
C.已知:几种物质沉淀时的pH如下表:
请问答下列问题:
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是增大反应物的接触面积或加快溶解速率.
(2)写出在粗ZnO样品中加硫酸发生反应的化学方程式:ZnO+H2SO4=ZnSO4+H2O(选写一个).
(3)反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是3.2到5.2.
(4)操作A的名称是过滤,该过程中使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(5)反应2中加入锌发生的反应属于置换反应(填化学反应基本类型).
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+的方法为取样滴加氢氧化钠溶液,微热,(或加熟石灰研磨)用湿润的红色石蕊试纸放在容器的上方,若试纸变蓝,则表明含铵根离子.
制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:

查阅资料:A.粗ZnO中常含杂质FeO、CuO
B.反应3是为了制得碱式碳酸锌,碱式碳酸锌经焙烧可制得活性ZnO
C.已知:几种物质沉淀时的pH如下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去. | ||||
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是增大反应物的接触面积或加快溶解速率.
(2)写出在粗ZnO样品中加硫酸发生反应的化学方程式:ZnO+H2SO4=ZnSO4+H2O(选写一个).
(3)反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是3.2到5.2.
(4)操作A的名称是过滤,该过程中使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(5)反应2中加入锌发生的反应属于置换反应(填化学反应基本类型).
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+的方法为取样滴加氢氧化钠溶液,微热,(或加熟石灰研磨)用湿润的红色石蕊试纸放在容器的上方,若试纸变蓝,则表明含铵根离子.
16.“鱼浮灵”主要成分是过碳酸钠(xNa2CO3•yH2O2),俗称固体双氧水.兴趣小组对其进行以下探究:
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有二氧化碳生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】
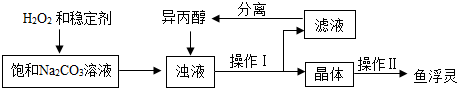
注:异丙醇为有机溶剂.
(3)稳定剂的作用是防止过碳酸钠分解;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
(4)浊液中加入异丙醇的作用是减少过碳酸钠的溶解.
(5)操作Ⅱ中洗涤晶体的试剂最好选用C(填字母).
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是15~20℃.
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数.
【组成测定】利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).
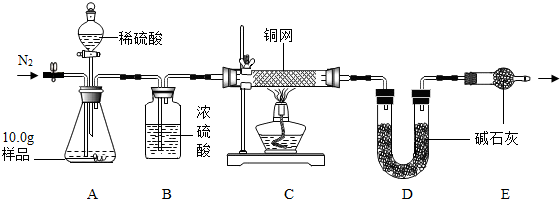
查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2.
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(9)装置B的作用是①②(填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%%;属于合格品(填“一等品”或“合格品”);x:y=2:3.
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有二氧化碳生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】

注:异丙醇为有机溶剂.
(3)稳定剂的作用是防止过碳酸钠分解;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
(4)浊液中加入异丙醇的作用是减少过碳酸钠的溶解.
(5)操作Ⅱ中洗涤晶体的试剂最好选用C(填字母).
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是15~20℃.
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
【组成测定】利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).

查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2.
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(9)装置B的作用是①②(填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%%;属于合格品(填“一等品”或“合格品”);x:y=2:3.
3.下列对实验现象和结论描述都正确的是( )
| A. | 打开浓盐酸瓶口产生白烟,说明盐酸具有挥发性 | |
| B. | 二氧化碳通入紫色石蕊试液中,溶液变红,说明二氧化碳具有酸性 | |
| C. | 滴有品红的水通过活性炭后变无色,说明活性炭具有吸附性 | |
| D. | 铁丝在空气中燃烧火星四射,说明铁具有可燃性 |
20. 现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )
现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )
 现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )
现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )| A. | 只收集到CO气体 | B. | 只收集到CO2气体 | ||
| C. | 先收集到CO气体,后收集到CO2气体 | D. | 先收集到CO2气体,后收集到CO气体 |
1.厨房里发生的化学变化中,属于物理变化的是( )
| A. |  煤气燃烧 | B. |  面包发霉 | C. |  榨取果汁 | D. |  菜刀生锈 |
