题目内容
1.北京在申办2008年奥运会时提出了“科技奥运,人文奥运,绿色奥运”的口号,为了使2008年北京奥运会办成绿色奥运会,下列做法不可取的是( )| A. | 关闭所有化工厂 | B. | 植树种草,增大绿地面积 | ||
| C. | 提高污水处理率 | D. | 机动车的尾气经处理后排放 |
分析 本题主要考查的是环境污染和防治,空气污染的途径主要有两个:有害气体和粉尘.有害气体主要有一氧化碳、二氧化硫、二氧化氮等气体;粉尘主要指一些固体小颗粒.水污染的途径是:工业三废和生活污水的任意排放;农业上化肥和农药的不合理使用.二氧化硫主要来源于煤、石油等燃料的燃烧,工厂排放的废气等;一氧化碳主要来源于化石燃料的不完全燃烧和汽车的尾气等,二氧化氮主要来源于机动车排放的废气和燃放烟花爆竹.
解答 解:A、工业“三废”应处理后再排放,但不能关闭所有化工厂是不现实的,符合题意;
B、植树种草,增大绿地面积能净化空气,减少环境污染,不符合题意;
C、提高污水处理率可以减少水资源的污染,不符合题意;
D、机动车的尾气经处理后排放可以减少空气污染,不符合题意.
故选A.
点评 环保问题已经引起了全球的重视,关于“三废”的处理问题和空气的污染问题,是中考的热点问题,当然垃圾处理也要考虑避免造成二次污染,化学上提倡绿色化学工艺,要从源头上杜绝污染.因此2008奥运会提出了“科技奥运、人文奥运、绿色奥运”的口号,提倡绿色化学,防止污染.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
11.小英同学用量筒量取液体,把量筒放好后,仰视量筒内的液体凹液面的最低处,读数为20ml:倒出部分液体后,俯视凹液面最低处,读数为5ml.则小英同学实际倒出液体的体积为( )
| A. | 15ml | B. | 大于15ml | C. | 小于15ml | D. | 无法确定 |
12.2003年3月,美英联军在伊拉克遭遇“沙尘暴”.“沙尘暴”已成为世界环境问题中的一个重点问题,下列措施中可以防止“沙尘暴”的是( )
| A. | 植树造林,加强绿化 | B. | 合理使用化肥农药 | ||
| C. | 工业废气经处理达标后再排放 | D. | 矿物产品的综合开发和利用 |
6.实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
(1)则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应.
②二氧化碳在饱和的碳酸氢钠溶液中几乎不溶解,在27℃、101kPa时的密度为1.8g•L-1.
【实验探究1】
(2)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】
小红同学设计了如图1所示的装置(铁架台略去),在27℃、101kPa下按下列步骤进行实验:
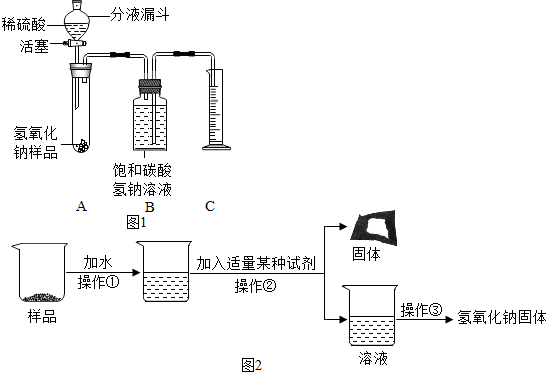
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入X溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到X溶液220mL.
(3)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检查装置的气密性.
(4)B中集气瓶盛装的X溶液应为饱和碳酸氢钠溶液.
(5)试管中原有的空气对实验结果没有(选填“有”或“没有”)明显影响.
(6)变质氢氧化钠样品中碳酸钠的质量分数为48%(精确至1%).
【提出问题3】怎样提纯该样品得到较纯净的氢氧化钠固体?
【实验探究3】
为了得到较纯净的氢氧化钠固体,小亮明设计了如图2所示的实验流程.
(7)操作②的名称是过滤,为了使样品充分溶解,操作①中还要用到的玻璃仪器是玻璃棒.
(8)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(9)最终所得氢氧化钠固体的质量变质样品中氢氧化钠的质量大于(选填“大于”、“等于”或“小于”).
【反思与交流】
(10)敞口放置的氢氧化钠溶液容易变质,所以试剂瓶要用橡皮塞密封保存.
(11)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质后某成分的含量,以及除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地
④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(12)【实验探究1】中的检验和【实验探究3】中的除杂都将碳酸钠进行了转化,但二者目的不同,它们分别是检验中将碳酸钠转化为氯化钠,以排除对氢氧化钠检验的干扰、除杂中是将碳酸钠转化为产品氢氧化钠.
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
(1)则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应.
②二氧化碳在饱和的碳酸氢钠溶液中几乎不溶解,在27℃、101kPa时的密度为1.8g•L-1.
【实验探究1】
(2)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (a)取少量样品溶于水,加入过量的氯化钙溶液; | 有白色沉淀产生 | 该反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl |
| (b)静置,向将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅱ成立 |
【实验探究2】
小红同学设计了如图1所示的装置(铁架台略去),在27℃、101kPa下按下列步骤进行实验:

①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入X溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到X溶液220mL.
(3)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检查装置的气密性.
(4)B中集气瓶盛装的X溶液应为饱和碳酸氢钠溶液.
(5)试管中原有的空气对实验结果没有(选填“有”或“没有”)明显影响.
(6)变质氢氧化钠样品中碳酸钠的质量分数为48%(精确至1%).
【提出问题3】怎样提纯该样品得到较纯净的氢氧化钠固体?
【实验探究3】
为了得到较纯净的氢氧化钠固体,小亮明设计了如图2所示的实验流程.
(7)操作②的名称是过滤,为了使样品充分溶解,操作①中还要用到的玻璃仪器是玻璃棒.
(8)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(9)最终所得氢氧化钠固体的质量变质样品中氢氧化钠的质量大于(选填“大于”、“等于”或“小于”).
【反思与交流】
(10)敞口放置的氢氧化钠溶液容易变质,所以试剂瓶要用橡皮塞密封保存.
(11)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质后某成分的含量,以及除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地
④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(12)【实验探究1】中的检验和【实验探究3】中的除杂都将碳酸钠进行了转化,但二者目的不同,它们分别是检验中将碳酸钠转化为氯化钠,以排除对氢氧化钠检验的干扰、除杂中是将碳酸钠转化为产品氢氧化钠.
11.下列说法不正确的是( )
| A. | 实验时,用剩的药品要放回到原试剂瓶中,以免浪费 | |
| B. | 实验时,如果没有说明液体药品的用量时,应取1~2 mL | |
| C. | 给试管里的液体加热时,试管要与桌面成45度角 | |
| D. | 给试管里的固体加热时,应注意使试管口略向下倾斜 |