题目内容
1.某物质1.6g在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,则关于该物质说法中正确的是( )| A. | 一定含有碳元素、氢元素、可能含有氧元素 | |
| B. | 一定含有碳元素、氢元素、氧元素 | |
| C. | 一定只含有碳元素、氢元素 | |
| D. | 该物质中碳、氢原子个数比为1:3 |
分析 根据质量守恒定律,由生成物可以初步确定该物质中含有氢元素和氧元素,由生成的二氧化碳和水中碳、氢元素的质量和与该物质的质量进行对比,从而确定该物质的组成元素;据此进行分析判断.
解答 解:4.4gCO2中含有碳元素的质量为:4.4g×$\frac{12}{44}$100%=1.2g,3.6g水中含有氢元素的质量为:3.6g×$\frac{1×2}{18}$×100%=0.4g,生成物4.4g二氧化碳和3.6g水所含碳、氢元素的质量和=1.2g+0.4g=1.6g,等于该物质的质量,则该物质中一定含有碳、氢两种元素,不含氧元素.
A、由上述分析可知,该物质只含有碳元素和氢元素,不含氧元素,故选项说法错误.
B、由上述分析可知,该物质只含有碳元素和氢元素,不含氧元素,故选项说法错误.
C、由上述分析可知,该物质只含有碳元素和氢元素,故选项说法正确.
D、该物质的分子中碳原子与氢原子的个数比为$\frac{1.2g}{12}:\frac{0.4g}{1}$=1:4,故选项说法不正确.
故选C.
点评 本题难度稍大,主要考查了质量守恒定律、化学式的计算,解题的关键是根据质量守恒定律确定确定物质的元素组成.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
12.往100mL酒精中加入100mL水,充分混合后,液体的总体积小于200mL,主要原因是( )
| A. | 分子间有间隔 | B. | 酒精挥发了 | ||
| C. | 分子在不断地运动 | D. | 分子变小了 |
10.石墨烯又称单层墨,它仅由一层碳原子组成,具有许多奇特的属性,包括极强的拉力,优良的导电性和导热性,硬度最大,熔点超过3000℃等,这种高新材料有可能代替硅成为新的半导体材料.根据石墨烯的特性,你认为石墨烯不能用来制成( )
| A. | 输电线 | B. | 坚韧的防弹衣 | C. | 保温隔热材料 | D. | 发光二极管 |
11.鉴别稀盐酸和稀硫酸可选用的试剂是( )
| A. | Cu(OH)2 | B. | 紫色石蕊试液 | C. | BaCl2 | D. | Fe2O3 |
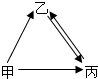 如图中甲、乙、丙均为初中化学常见的物质,已知它们均含有地壳中含量最多的元素,它们之间有如图所示的转化关系,丙是单质;甲、乙通常为液体,请按要求填写下列空白:
如图中甲、乙、丙均为初中化学常见的物质,已知它们均含有地壳中含量最多的元素,它们之间有如图所示的转化关系,丙是单质;甲、乙通常为液体,请按要求填写下列空白: