题目内容
1.从H、O、C、N、Na、Fe、Ca七种元素中,选择适当的元素组成符合下列要求的物质,并用化学式填空(未要求填写个数的,每空只填一种物质).(1)相对分子质量最小的氧化物是H2O;
(2)酸性氧化物是CO2(合理即可);
(3)农业上用来降低土壤酸性,改良土壤结构的是Ca(OH)2;
(4)农业上作为氮肥的是CO(NH2)2(合理即可).
分析 首先根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学式的方法和步骤写出物质的化学式即可.
解答 解:(1)相对分子质量为构成分子的各原子的相对原子质量之和;氧化物是只含有两种元素且其中一种元素是氧元素的化合物,相对分子质量最小的氧化物是水,其化学式为:H2O.
(2)二氧化碳能与碱溶液反应生成盐和水,属于酸性氧化物,其化学式为:CO2(合理即可).
(3)氢氧化钙具有碱性,属于碱,可用于改良酸性土壤,其化学式为:Ca(OH)2.
(4)尿素农业上作为氮肥,其化学式为:CO(NH2)2(合理即可).
故答案为:(1)H2O;(2)CO2(合理即可);(3)Ca(OH)2;(4)CO(NH2)2(合理即可).
点评 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在;解题时应注意只能从给出的元素中选择来组成物质.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
11.如图是A、B、C 三种物质的溶解度曲线,下列分析正确的是( )


| A. | 50℃时,把50gA物质放入50g水中能得到100g溶液 | |
| B. | A中混有少量的B,可用降温结晶法提纯 | |
| C. | 将C物质的饱和溶液变为不饱和,可采用升高温度或加水的方法 | |
| D. | 将20℃时A、B、C三种物质的饱和溶液升高到50℃,A溶液中的溶质质量分数最大 |
12.下列实验现象描述正确的是( )
| A. | 硫在氧气中燃烧产生淡蓝色火焰 | |
| B. | 细铁丝在空气中燃烧,火星四射,生成黑色固体 | |
| C. | 向滴有酚酞的氢氧化钠溶液中,通入足量的二氧化碳,溶液会由红色变为无色 | |
| D. | 红磷在氧气中燃烧能产生大量的白烟 |
9.下列实验操作的方法中正确的是( )
| A. | 给试管加热之前要先预热 | |
| B. | 用50 mL的量筒量取5.55 mL的氯化钠溶液 | |
| C. | 将氢氧化钠固体直接放在托盘天平的托盘上称量 | |
| D. | 用pH试纸直接浸入溶液中测溶液的pH |
6.黄曲霉素(化学式为C17H12O6)广泛存在于变质的花生、玉米和谷物等农产品中,下列有关说法错误的是( )
| A. | 黄曲霉素的相对分子质量为312 | |
| B. | 黄曲霉素有很强的毒性 | |
| C. | 黄曲霉素中碳、氢、氧三种元素的质量比为17:12:6 | |
| D. | 黄曲霉素是由碳、氢、氧三种元素组成的 |
13.某科学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用8g石灰石样品,把100g稀盐酸分为4次加入样品中(杂质既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
(1)从以上数据可知,这四次实验中,第3、4次实验反应后盐酸有剩余.
(2)表中m=3;n=1.2.
(3)求石灰石样品中碳酸钙的质量分数.
(4)求实验室所用稀盐酸的溶质质量分数.
| 序号 | 加入稀盐酸的质量(g) | 剩余固体的质量(g) |
| 1 | 25 | 5.5 |
| 2 | 25 | m |
| 3 | 25 | 1.2 |
| 4 | 25 | n |
(2)表中m=3;n=1.2.
(3)求石灰石样品中碳酸钙的质量分数.
(4)求实验室所用稀盐酸的溶质质量分数.
10.下列实验中,酒精灯的使用正确的是( )
| A. |  加热液体 | B. |  点燃酒精灯 | C. |  添加酒精 | D. |  熄灭酒精灯 |
11.实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
【活动与探究一】用对比实验方法探究二氧化碳的性质.
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色,结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
(3)实验三目的是探究温度对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和溶质、溶剂的质量相等.
【活动与探究三】定量测定空气中氧气的含量.
(4)实验五中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据下表提供的实验数据,完成下表:
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小(填“偏小”、“偏大”或“无影响”).
【活动与探究一】用对比实验方法探究二氧化碳的性质.
| 实验一 | 实验二 |
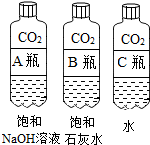 | 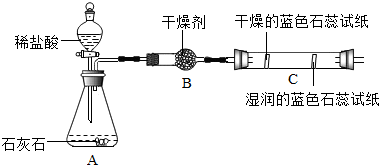 |
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色,结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
| 实验三 | 实验四 |
 |  |
【活动与探究三】定量测定空气中氧气的含量.
| 实验五 | |
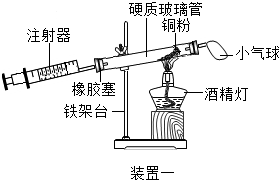 | 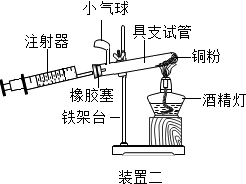 |
根据下表提供的实验数据,完成下表:
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL | 16% |
