题目内容
如表为元素周期表中某一周期元素的原子结构示意图.请回答下列问题:
| 元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
| 元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
| 原子结构示意图 | 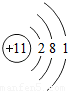 | 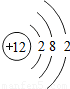 | 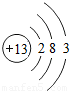 | 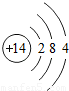 | 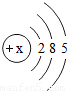 | 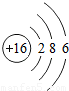 | 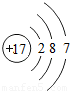 | 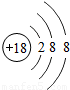 |
(2)表中具有相对稳定结构的元素是 .
(3)在化学反应中,每个铝原子失去 个电子形成铝离子.
(4)镁元素与氯元素形成的化合物化学式为 .
(5)上述元素在周期表中处于同一周期的原因是 .
(6)硫与氧气的反应(S+O2
 SO2)可用图表示:
SO2)可用图表示: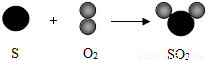
N个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为 N.
【答案】分析:(1)由表中原子结构示意图,再根据“核内质子数=核外电子数”,可求x的值;
(2)电子层≥2时,具有相对稳定结构的元素的最外层电子数应为8,由表中原子结构示意图可知,故可知为哪种元素;
(3)由铝元素的原子结构示意图可知,其得失电子的情况;
(4)由镁元素与氯元素的原子结构示意图可知,镁原子最外层电子数为2,易失去而带2个正电荷,则其化合价为+2价;同理氯元素的化合价为-1价,利用化学式的书写原则,可知他们形成的化合物的化学式;
(5)归纳总结上述元素在周期表中处于同一周期的原因;
(6)由硫与氧气的反应(S+O2 SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;则可求则64g氧气与足量硫粉完全反应生成的二氧化硫分子数.
SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;则可求则64g氧气与足量硫粉完全反应生成的二氧化硫分子数.
解答:解:(1)由表中原子结构示意图,再根据“核内质子数=核外电子数”,故x=2+8+5=15;
(2)具有相对稳定结构的元素的最外层电子数应为8,则为氩元素,其化学式为Ar;
(3)由铝元素原子结构示意图可知,其最外层电子数为3,故在化学反应中,每个铝原子失去3个电子形成铝离子;
(4)由镁元素与氯元素的原子结构示意图可知,镁原子最外层电子数为2,易失去而带2个正电荷,则其化合价为+2价;同理氯元素的化合价为-1价,先标注化合价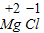 ,利用化合价数值交叉法书写化学式为:MgCl2;
,利用化合价数值交叉法书写化学式为:MgCl2;
(5)归纳总结上述元素在周期表中处于同一周期的原因为:具有相同的电子层数;
(6)由硫与氧气的反应(S+O2 SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;64g氧气含有2N个氧气分子,故64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;64g氧气含有2N个氧气分子,故64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
故答为:(1)15;(2)Ar;(3);(4)MgCl2;(5)具有相同的电子层数;(6)2N.
点评:了解元素周期表的特点及其应用;了解原子结构示意图与离子结构示意图的特点;核外电子在化学反应中的作用;了解原子和离子的相互转化.
(2)电子层≥2时,具有相对稳定结构的元素的最外层电子数应为8,由表中原子结构示意图可知,故可知为哪种元素;
(3)由铝元素的原子结构示意图可知,其得失电子的情况;
(4)由镁元素与氯元素的原子结构示意图可知,镁原子最外层电子数为2,易失去而带2个正电荷,则其化合价为+2价;同理氯元素的化合价为-1价,利用化学式的书写原则,可知他们形成的化合物的化学式;
(5)归纳总结上述元素在周期表中处于同一周期的原因;
(6)由硫与氧气的反应(S+O2
 SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;则可求则64g氧气与足量硫粉完全反应生成的二氧化硫分子数.
SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;则可求则64g氧气与足量硫粉完全反应生成的二氧化硫分子数.解答:解:(1)由表中原子结构示意图,再根据“核内质子数=核外电子数”,故x=2+8+5=15;
(2)具有相对稳定结构的元素的最外层电子数应为8,则为氩元素,其化学式为Ar;
(3)由铝元素原子结构示意图可知,其最外层电子数为3,故在化学反应中,每个铝原子失去3个电子形成铝离子;
(4)由镁元素与氯元素的原子结构示意图可知,镁原子最外层电子数为2,易失去而带2个正电荷,则其化合价为+2价;同理氯元素的化合价为-1价,先标注化合价
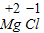 ,利用化合价数值交叉法书写化学式为:MgCl2;
,利用化合价数值交叉法书写化学式为:MgCl2;(5)归纳总结上述元素在周期表中处于同一周期的原因为:具有相同的电子层数;
(6)由硫与氧气的反应(S+O2
 SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;64g氧气含有2N个氧气分子,故64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
SO2),可知其各物质的质量关系;N个氧气分子的质量为32g,完全反应生成的二氧化硫分子数为N个;64g氧气含有2N个氧气分子,故64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.故答为:(1)15;(2)Ar;(3);(4)MgCl2;(5)具有相同的电子层数;(6)2N.
点评:了解元素周期表的特点及其应用;了解原子结构示意图与离子结构示意图的特点;核外电子在化学反应中的作用;了解原子和离子的相互转化.

练习册系列答案
相关题目



















 ___________。
___________。 SO2)可用如图表示:
SO2)可用如图表示:
